
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中_____区;第二周期元素中,第一电离能比氧大的有_____种。
(2)O3可用于消毒。O3的中心原子的杂化形式为_____;其分子的VSEPR模型为_____,与其互为等电子体的离子为_____(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为_____。
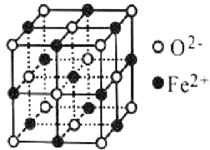
(4)氧元素可与Fe形成低价态氧化物FeO。FeO立方晶胞结构如图所示,则Fe2+的配位数为_____;与O2-紧邻的所有Fe2+构成的几何构型为_____。
【答案】p 3 sp2杂化 平面三角形 NO2- 乙醇分子间可形成氢键,沸点高 6 正八面体
【解析】
(1)除了ds区外,区的名称来自按构造原理最后填入电子的能级的符号;第二周期元素中,第一电离能比O元素大的有N、F、Ne元素;
(2)O3的中心原子的价层电子对个数=2+![]() =3且含有1个孤电子对,根据价层电子对互斥理论判断中心原子的杂化形式及其分子的VSEPR模型,与其互为等电子体的离子中含有3个原子、价电子数是18;
=3且含有1个孤电子对,根据价层电子对互斥理论判断中心原子的杂化形式及其分子的VSEPR模型,与其互为等电子体的离子中含有3个原子、价电子数是18;
(3)形成分子间氢键的物质熔沸点较高;
(4)Fe2+的配位数为6;与O2-紧邻的所有Fe2+构成的几何构型为正八面体。
(1)除了ds区外,区的名称来自按构造原理最后填入电子的能级的符号,O原子最后通入的电子是p电子,所以O元素位于p区;第二周期元素中,第一电离能比O元素大的有N、F、Ne元素,所以有3种元素;
(2)O3的中心原子的价层电子对个数=2+![]() =3且含有1个孤电子对,根据价层电子对互斥理论判断中心原子的杂化形式为sp2杂化、其分子的VSEPR模型为平面三角形,与其互为等电子体的离子中含有3个原子、价电子数是18,与其互为等电子体的阴离子有NO2-(合理即可);
=3且含有1个孤电子对,根据价层电子对互斥理论判断中心原子的杂化形式为sp2杂化、其分子的VSEPR模型为平面三角形,与其互为等电子体的离子中含有3个原子、价电子数是18,与其互为等电子体的阴离子有NO2-(合理即可);
(3)形成分子间氢键的物质熔沸点较高,乙醇能形成分子间氢键、甲醚不能形成分子间氢键,所以乙醇的熔沸点比甲醚高;
(4)Fe2+的配位数为6;与O2-紧邻的所有Fe2+构成的几何构型、与Fe2+紧邻的所有O2-构成的几何构型相同,根据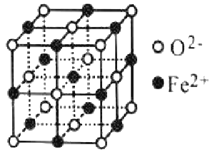 知,表中有标记的这几个离子形成正八面体,则与O2-紧邻的所有Fe2+构成的几何构型为正八面体。
知,表中有标记的这几个离子形成正八面体,则与O2-紧邻的所有Fe2+构成的几何构型为正八面体。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某同学按下图所示实验装置探究铜与浓硫酸的反应,记录实验现象见下表。
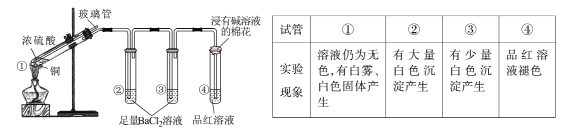
下列说法正确的是
A.②中白色沉淀是BaSO3
B.①中可能有部分硫酸挥发了
C.为确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为![]()
B.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C.1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
D.某电池的总反应为Fe+2Fe3+=3Fe2+,当有5.6gFe溶解时电路中有0.2mol e-通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiO2晶体的部分结构如图所示,关于该晶体下列说法错误的是( )

A.Si原子杂化类型为sp3
B.Si、O的原子个数比为1:4
C.Si原子数目与Si—O键数目比为1:4
D.SiO2晶体中最小环为12元环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数的值,下列说法不正确的是( )
A.18g冰(图1)中含O—H键数目为2NA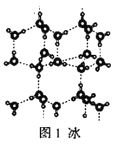
B.28g晶体硅(图2)中含有Si—Si键数目为2NA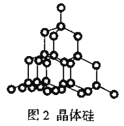
C.44g干冰(图3)中含共用电子对2NA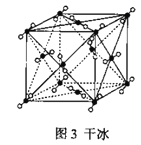
D.石墨烯(图4)是碳原子单层片状新材料,12g石墨烯中含C—C键数目为1.5NA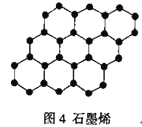
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
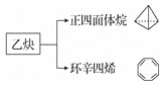
下列说法正确的是( )
A.正四面体烷的分子式为C4H8B.正四面体烷二氯取代产物有1种
C.环辛四烯核磁共振氢谱有2组峰D.环辛四烯与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)![]() 分子的晶体中,在晶胞的顶点和面心均含有一个
分子的晶体中,在晶胞的顶点和面心均含有一个![]() 分子,则一个
分子,则一个![]() 晶胞的质量为_______。
晶胞的质量为_______。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是_____(填字母)。
a.晶体的熔点:干冰>冰
b.晶体中的空间利用率:干冰>冰
c.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的是______(填字母)。
a.金刚石中碳原子的杂化类型为![]() 杂化,石墨中碳原子的杂化类型为
杂化,石墨中碳原子的杂化类型为![]() 杂化
杂化
b.晶体中共价键的键长:金刚石中![]() <石墨中
<石墨中![]()
C.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
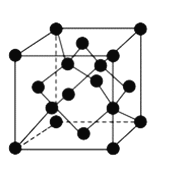
(4)金刚石晶胞结构如下图,立方![]() 结构与金刚石相似,在
结构与金刚石相似,在![]() 晶体中,
晶体中,![]() 原子周围最近的
原子周围最近的![]() 原子所构成的立体图形为_______,
原子所构成的立体图形为_______,![]() 原子与
原子与![]() 原子之间共价键与配位键的数目比为_______,一个晶胞中
原子之间共价键与配位键的数目比为_______,一个晶胞中![]() 原子数目为___________。
原子数目为___________。
(5)已知![]() 单质的晶体密度为
单质的晶体密度为![]() ,
,![]() 的相对原子质量为
的相对原子质量为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则
,则![]() 的原子半径为_________。
的原子半径为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上作了如下记录,其中合理的是 ( )
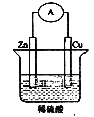
实验记录:①导线中电流方向:锌→铜②铜极上有气泡产生③锌片变薄
实验结论:④Zn为正极,Cu为负极⑤铜比锌活泼⑥H+向铜片移动
A.①②③B.④⑤⑥C.③④⑤D.②③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com