


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 .
.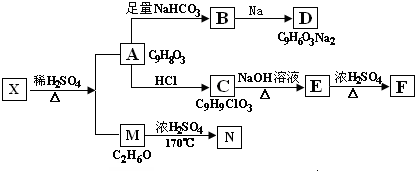
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、同等条件下,正丁腈在水中的溶解度比在乙醚中的溶解度大 |
| B、其分子式为C4H7N,其密度比水大 |
| C、它还可被命名为氰代丙烷,正丙基氰等,其结构中不含氢键 |
| D、正丁腈由丁烯与氨氧化而得,或由丁醇与氨催化氧化而得 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 |  |  |  |  |  |  |
| 每个橡皮塞上都打了两个孔 | ||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com