
| 3.12g |
| 78g/mol |
| 0.12mol |
| 2mol/L |
| 0.36mol |
| 2mol/L |


科目:高中化学 来源: 题型:
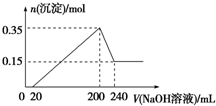 将一定质量的镁和铝混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示.则下列说法不正确的是( )| A、镁和铝的总质量为9g |
| B、合金与稀硫酸反应生成的氢气体积为10.08L |
| C、稀硫酸的物质的量浓度为2.5mol/L |
| D、氢氧化钠溶液的物质的量浓度为5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室中通常用浓硫酸使乙醇脱水制取少量乙烯,反应机理如为:CH3CH2OH→C2H4↑+H2O.实验中常因温度过高使乙醇与浓硫酸反应生成少量的二氧化硫气体.有人设计了如图的实验,以确定上述混合气体中是否含有乙烯和二氧化硫.
实验室中通常用浓硫酸使乙醇脱水制取少量乙烯,反应机理如为:CH3CH2OH→C2H4↑+H2O.实验中常因温度过高使乙醇与浓硫酸反应生成少量的二氧化硫气体.有人设计了如图的实验,以确定上述混合气体中是否含有乙烯和二氧化硫.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年12月14日,嫦娥三号顺利月面软着陆,月球车表面包裹F46膜,F46膜是由四氟乙烯和全氟丙烯共聚而成.下列有关说法正确的是( )
2013年12月14日,嫦娥三号顺利月面软着陆,月球车表面包裹F46膜,F46膜是由四氟乙烯和全氟丙烯共聚而成.下列有关说法正确的是( )| A、F46膜是纯净物 |
| B、全氟丙烯属于有机物 |
| C、全氟丙烯所有原子共平面 |
| D、四氟乙烯分子中只含非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com