
| A、Fe2+、Na+、NO3-、Cl- |
| B、Al3+、Na+、Cl-、NO3- |
| C、K+、Na+、Cl-、AlO2- |
| D、K+、NH4+、SO42-、NO3- |


科目:高中化学 来源: 题型:
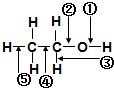
| A、和金属钠作用时,键①断裂 |
| B、和浓硫酸共热至170℃时,键②和⑤断裂 |
| C、和HBr共热时,键④断裂 |
| D、在铜催化下和氧气反应时,键①和③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m=4 | B、a=b |
| C、b<a | D、m等于2或1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.5 mol |
| B、2 mol |
| C、1 mol |
| D、5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+ Na+ NO3- Cl- |
| B、Ba2+ Na+ NO3- Cl- |
| C、SO42- SO32- NH4+ Na+ |
| D、Mg2+ Na+ Br- ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H<0,△S>0 |
| B、△H>0,△S>0 |
| C、△H<0,△S<0 |
| D、△H>0,△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
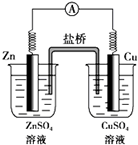
| A、反应中,盐桥中的Cl-会移向ZnSO4溶液 |
| B、取出盐桥后,电流计依然发生偏转 |
| C、铜片上有气泡逸出 |
| D、锌为负极,发生还原反应,电极反应式为:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.5×10-2 |
| B、0.25 |
| C、4.0 |
| D、4.0×102 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com