

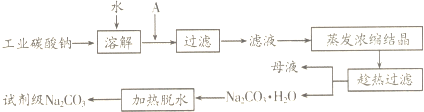
分析 (1)浓硫酸为高沸点酸,能制取低沸点的酸氯化氢,食盐和浓硫酸反应生成氯化氢和硫酸钠;由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成;
(2)根据该方法选用试剂和条件判断;
(3)碳酸钙在石灰窑中加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙;
(4)氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl;
(5)能提高原料的利用率,减少废渣的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高; NH4Cl 可做氮肥;可与合成氨厂联合,可利用合成氨的产物CO2;
(6)不可行.因为KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,KHCO3的溶解度大于NH4Cl,降温结晶时会析出较多的KCl.
解答 解:(1)利用高沸点酸制备挥发性酸,且HCl极易溶于水,故利用直接使用浓硫酸和氯化钠制取氯化氢,反应为:2NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑,
由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成,故反应方程式为:Na2SO4+4C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+2CO2,
故答案为:2NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑;Na2SO4+4C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+2CO2;
(2)该方法选用浓硫酸在高温下反应,所以缺点为生产时需要高温,浓硫酸对设备腐蚀严重,故答案为:该方法生产时需要高温,浓硫酸对设备腐蚀严重;
(3)碳酸钙在石灰窑中加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙,故C为Ca(OH)2;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙,故D为NH3,
故答案为:CO2;Ca(OH)2;NH3;
(4)氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl,反应方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl,
故答案为:NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;
(5)该方法能提高原料的利用率,减少废渣的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥;可与合成氨厂联合,可利用合成氨的产物CO2,
故答案为:提高食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物CO2;
(6)由溶解曲线图可知KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,由图象可知,降温结晶时会析出较多的KCl,无法大量析出碳酸氢钾;
故答案为:不可行; 碳酸氢钾的溶解度较大,降温过程中不会析出碳酸氢钾晶体.
点评 本题考查制碱法的工艺的流程,需要学生细读生产工艺图中各物质的变化进行解答,注意根据物质的主要性质分析工业装置和反应原理,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 反应条件是加热的反应都是吸热反应 | |
| B. | 化学反应除了生成新的物质外,通常放出大量热 | |
| C. | 物质燃烧一定是放热反应 | |
| D. | 放热的化学反应不需要加热就能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为牺牲阳极的阴极保护法 | |
| B. | 原电池工作时,电流的方向由正极→负载→负极→原电池中电解质溶液→正极 | |
| C. | 纯银在空气中久置变黑发生的是化学腐蚀 | |
| D. | 在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液和稀盐酸反应:H++OH-═H2O | |
| B. | 大理石与盐酸反应制取二氧化碳:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁粉投入盐酸溶液中:2Fe+6H+═Fe3++3H2↑ | |
| D. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
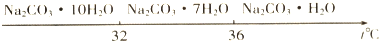
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
| A. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,滴加氢氧化钠溶液时Fe2+先产生沉淀 | |
| B. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,若除去混合溶液中的Fe2+、Fe3+,可先加入稀硝酸,再加入氧化铜调节溶液的pH的范围为3.2-4.7 | |
| C. | 相同温度下,Ksp[(Cu(OH)2)>Ksp[(Fe(OH)2) | |
| D. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,除去混合溶液中的Fe2+、Fe3+,可加入足量的铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | Cr3+ | C. | Zn2+ | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com