
| A.2NaBr + Cl2 =" 2NaCl" + Br2 |
| B.KClO3 + 6HCl ="==" KCl + 3Cl2↑ + 3H2O |
| C.2H2S + SO2 = 3S↓ + 2H2O |
| D.AlCl3 + 3NaAlO2 + 6H2O = 4Al(OH)3↓ + 3NaCl |
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
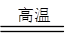 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中,每生成1 mol AlN需转移3 mol电子 |
| C.AlN中氮的化合价为+3 |
| D.AlN的摩尔质量为41 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4CuSO3中硫元素被氧化了 | B.刺激性气味的气体是二氧化硫或氨气 |
| C.该反应中NH4CuSO3既是氧化剂又是还原剂 | D.该反应中硫酸既表现为酸性又表现氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤⑥ | B.②④ | C.②④⑥ | D.①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2↑+Cl2↑ ______________________________
H2↑+Cl2↑ ______________________________查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com