
 cC + Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( )
cC + Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( )A.写成2aA + 2bB 2cC,Q值、K值均扩大了一倍 2cC,Q值、K值均扩大了一倍 |
B.写成2aA + 2bB 2cC,Q值扩大了一倍,K值保持不变 2cC,Q值扩大了一倍,K值保持不变 |
C.写成cC aA + bB,Q值、K值变为原来的相反数 aA + bB,Q值、K值变为原来的相反数 |
D.写成cC aA + bB,Q值变为原来的相反数,K值变为倒数 aA + bB,Q值变为原来的相反数,K值变为倒数 |
科目:高中化学 来源:不详 题型:单选题
 4NO(g)+6H2O(g) △H<0,下列措施能使平衡正向移动的是
4NO(g)+6H2O(g) △H<0,下列措施能使平衡正向移动的是| A.增大压强 | B.升高温度 | C.加入催化剂 | D.增大O2的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
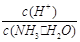 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.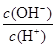
 4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):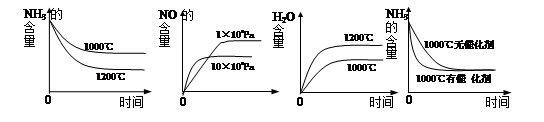
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第4 min | 0.3000 | 0.9750 | 0.5000 |
| 第6 min | 0.3000 | 0.9750 | 0.5000 |
| 第8 min | 0.7000 | 1.475 | 0.1000 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L。下列判断中正确的是
3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L。下列判断中正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
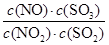 。达到平衡状态时,如果升高温度(其它条件不变),则K值减小。下列说法正确的是( )
。达到平衡状态时,如果升高温度(其它条件不变),则K值减小。下列说法正确的是( )A.反应的热化学方程式为NO2(g)+SO2(g)  NO(g)+SO3(g) ΔH>0 NO(g)+SO3(g) ΔH>0 |
| B.混合气体的平均摩尔质量保持不变,说明反应已达平衡 |
| C.一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深 |
| D.使用合适的催化剂可使该反应的反应速率和平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.58 | 20.00 |
| 3 | 0.10 | 22.60 | 20.00 |



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3达到一定限度后通入18O2,一段时间18O可能存在于( )
2SO3达到一定限度后通入18O2,一段时间18O可能存在于( )| A.SO3和O2 中 | B.SO3和SO2 中 |
| C.SO3, SO2和O2 中 | D.SO2和O2 中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g) ΔH=-QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2。下列叙述不正确的是( )
2C(g) ΔH=-QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2。下列叙述不正确的是( ) A(g)+3B(g) ΔH= +Q2 kJ/mol
A(g)+3B(g) ΔH= +Q2 kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器
N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器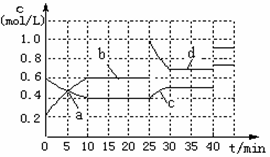
| A.a、b、c、d四个点中处于平衡状态的点是a、b |
| B.反应进行至25min时,曲线发生变化的原因是加入了 0.4molN |
| C.若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度 |
| D.若40min后出现如图所示变化,则可能是加入了某种催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com