
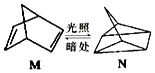
 含碳的化合物之间很容易发生转化.请回答下列问题:
含碳的化合物之间很容易发生转化.请回答下列问题: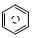 (l)的燃烧热为 3267.5kJ•mol-1,
(l)的燃烧热为 3267.5kJ•mol-1,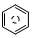 (l)+6O 2(g)═6CO2 (g)+3H2 (g)
(l)+6O 2(g)═6CO2 (g)+3H2 (g)分析 (1)该反应是将光能转化为化学能,反应吸热,物质能量越高越活泼,能量越低越稳定;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧放热,放热反应的焓变为负值比较大小,据此分析判断;
(3)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+490.0kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-280.0kJ•mol-1
③C(石墨)+O2(g)=CO2(g)△H=-390.5kJ•mol-1
依据盖斯定律计算,$\frac{1}{2}$(③×3-①-②×3)得到2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)反应的焓变.
解答 解:(1)M吸收了光能生成了N,能量转化形式为光能转化为化学能,反应为吸热反应,M能量低于N,则M能量低稳定,
故答案为:化学;M;
(2)(2)已知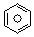 (l)的燃烧热为3267.5kJ•mol-1,
(l)的燃烧热为3267.5kJ•mol-1,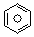 (l)+$\frac{15}{2}$O2(g)═6CO2(g)+3H2O(l)△H=-3267.5kJ•mol-1,
(l)+$\frac{15}{2}$O2(g)═6CO2(g)+3H2O(l)△H=-3267.5kJ•mol-1, (l)+6O2(g)═6CO2(g)+3H2(g)△H=a kJ•mol-1,氢气燃烧放热,放热反应的焓变为负值,则a>-3267.5kJ•mol-1,
(l)+6O2(g)═6CO2(g)+3H2(g)△H=a kJ•mol-1,氢气燃烧放热,放热反应的焓变为负值,则a>-3267.5kJ•mol-1,
故答案为:>;
(3)(3)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+490.0kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-280.0kJ•mol-1
③C(石墨)+O2(g)=CO2(g)△H=-390.5kJ•mol-1
依据盖斯定律计算,$\frac{1}{2}$(③×3-①-②×3)得到2Fe(s)+$\frac{3}{2}$O2(g)=Fe2O3(s)△H=-821.5KJ/mol,
故答案为:-821.5KJ/mol.
点评 本题考查了化学反应能量变化、燃烧热以及热化学方程式计算,掌握盖斯定律是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 能够便甲基橙变黄的溶液一定为碱性溶液 | |
| B. | 以KI溶液为标准溶液滴定未知浓度的FeCl3溶液,可选用淀粉溶液作为指示剂 | |
| C. | 使用量程为50mL的滴定管测量溶液体积时,开始时读数为21.00mL,将滴定管中剩余液体全部放出,则所得溶液体积大于29.00mL | |
| D. | 盛待测定的滴定管,第一次读数平视凹液面最低处,第二次仰视,则所测待测液浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 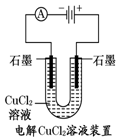 装置中阳极上析出红色固体 | |
| B. | 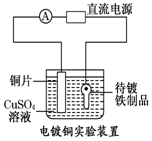 装置的待镀铁制品应与电源正极相连 | |
| C. | 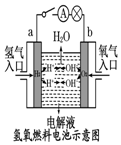 装置中外电路电子由a极流向b极 | |
| D. | 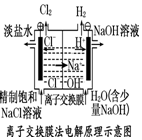 装置的阳极反应为:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 42.9 | 50.7 | 64.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5,4,3 | B. | 4,4,3 | C. | 4,3,3 | D. | 3,3,3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
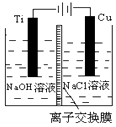 纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com