
| A. | 使酚酞变红色的溶液中:Na+、Fe2+、SO42-、Cl- | |
| B. | 使紫色石蕊试纸变红的溶液中:K+、Fe2+、NO3-、Ca2+ | |
| C. | 常温下PH=12的溶液中:Na+、I-、NO3-、Cl- | |
| D. | 与Al反应放出H2的溶液中:Na+、SO42-、ClO-、Cl- |
分析 A.使酚酞变红色的溶液中存在大量氢氧根离子,亚铁离子与氢氧根离子反应;
B.使紫色石蕊试纸变红的溶液中存在大量氢离子,硝酸根离子在酸性条件下能够氧化亚铁离子;
C.常温下pH=12的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢离子反应;
D.Al反应放出H2的溶液中存在大量氢离子或氢氧根离子,次氯酸根离子与氢离子反应.
解答 解:A.使酚酞变红色的溶液呈碱性,溶液中存在大量氢氧根离子,Fe2+与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.使紫色石蕊试纸变红的溶液呈酸性,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.常温下pH=12的溶液呈碱性,Na+、I-、NO3-、Cl-之间不发生反应,都不与碱性溶液中的氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.Al反应放出H2的溶液呈酸性或强碱性,ClO-与氢离子反应,在酸性溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
| A. | Cu2+,K+,NO3-,I- | B. | AlO2-,Na+,CO32-,K+ | ||
| C. | Ba2+,Fe3+,Cl-,S2- | D. | K+,SiO32-,S2-,Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
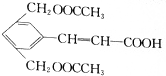 )在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C.回答下列问题:
)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C.回答下列问题: CH3COOCH2CH3+H2O,该反应的反应类型是酯化(取代)反应
CH3COOCH2CH3+H2O,该反应的反应类型是酯化(取代)反应 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 被鉴别的物质 | 鉴别物质(或鉴别方法) | 现象(填入序号即可) |
| 葡萄糖 | 新制氢氧化铜 | ④ |
| 淀粉 | 碘水 | ② |
| 蛋白质 | 浓硝酸 | ⑤ |
| 蛋白质 | 燃烧 | ① |
| 葡萄糖 | 银氨溶液 | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
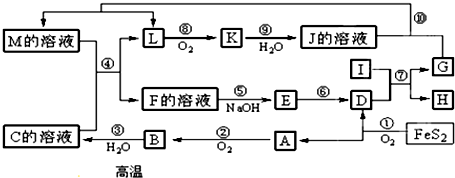
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
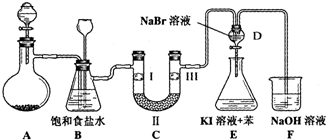
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
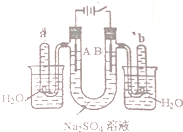 如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( )
如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( )| A. | 逸出气体的体积,A电极的小于B电极的 | |
| B. | 一电极逸出无味气体,另一电极逸出刺激性气味气体 | |
| C. | A电极附近呈红色,B电极附近呈蓝色 | |
| D. | 电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com