
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行)。
![]()
(1)若B的溶液显黄色,一定条件下B的饱和溶液可与沸水反应生成红褐色分散系
①实验室制A单质的反应的离子方程式_______________________________________;
A单质的常用检验方法____________________________
②C溶液中加入氢氧化钠溶液的现象_________________________________________;
③一定条件下W与水反应的化学方程式_______________________________________;
(2)若W为NaOH,且B为白色沉淀
①C的化学名称为______________;
②W与某金属单质也可生成C,该反应的离子方程式______________________________;
③B与W反应生成C的离子反应方程式________________________________________;
(3)若B能使品红褪色,加热又变红,C能与水反应生成一种强酸
①B转化为C的化学方程式_________________________________________________
②若A是一种化合物,A与B反应的化学方程式__________________________
【答案】MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O 湿润的淀粉碘化钾试纸 白色沉淀,然后迅速变为灰绿色,最后变为红褐色 3 Fe+4H2O(g)
Mn2++Cl2↑+2H2O 湿润的淀粉碘化钾试纸 白色沉淀,然后迅速变为灰绿色,最后变为红褐色 3 Fe+4H2O(g) ![]() Fe3O4+4H2 偏铝酸钠 2 Al+2OH-+2H2O=2AlO2-+3 H2↑ Al(OH)3+OH- = AlO2-+2H2O 2SO2 +O2
Fe3O4+4H2 偏铝酸钠 2 Al+2OH-+2H2O=2AlO2-+3 H2↑ Al(OH)3+OH- = AlO2-+2H2O 2SO2 +O2 ![]() 2SO3 2H2S+SO2=3S↓+2H2O
2SO3 2H2S+SO2=3S↓+2H2O
【解析】
(1)B的溶液显黄色,一定条件下B的饱和溶液可与沸水反应生成红褐色分散系,则B为氯化铁,则A为氯气,W为铁,C为氯化亚铁。
①实验室用浓盐酸与二氧化锰加热制氯气,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑;A单质为氯气,常用检验方法是湿润的淀粉碘化钾试纸检验是否变蓝;
Mn2++2H2O+Cl2↑;A单质为氯气,常用检验方法是湿润的淀粉碘化钾试纸检验是否变蓝;
②氯化亚铁溶液中加入氢氧化钠溶液,发生反应生成氢氧化亚铁,氢氧化亚铁被空气中的氧气氧化生成氢氧化铁,看到的现象为生成白色沉淀,迅速转化为灰绿色,最终变为红褐色;
③高温条件下铁与水反应的化学方程式为3 Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2) W为NaOH,且B为白色沉淀。少量氢氧化钠能够与铝盐反应生成氢氧化铝沉淀,氢氧化铝能够与过量氢氧化钠发生反应生成偏铝酸钠,因此A为铝盐,B为氢氧化铝,C为偏铝酸钠。
①C为偏铝酸钠;
②氢氧化钠与铝也可生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
③氢氧化铝是两性氢氧化物,溶于氢氧化钠的离子反应方程式为Al(OH)3+OH-=AlO2-+2H2O;
(3)若B能使品红褪色,加热又变红,C能与水反应生成一种强酸,则B为二氧化硫,C为三氧化硫,与水反应生成的强酸为硫酸,则W为氧气。
①B转化为C是二氧化硫在催化剂作用下与氧气反应生成三氧化硫,反应的化学方程式为2SO2 +O2 ![]() 2SO3;
2SO3;
②若A是一种化合物,能与氧气反应生成二氧化硫,则A为硫化氢,A与B反应的化学方程式为2H2S+SO2=3S↓+2H2O。


科目:高中化学 来源: 题型:
【题目】两份质量均为mg的Na2CO3、NaHCO3固体混合物,加热第一份充分反应得到CO2质量是xg,向加热后所得固体中加入足量的盐酸得到CO2 ag;向第二份中直接加入足量盐酸得到CO2的质量是bg.则x等于
A.2bB.2aC.b-2aD.b-a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,AgX(X=Cl、Br)的溶度积与c(Ag+)和c(X-)的相互关系如下图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是( )

A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K=10-4
AgBr(s)+Cl-(aq)平衡常数K=10-4
D. t℃时,取a点的AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 16 g由O2和O3的混合气体中含有的分子数为0.5NA
B. 2.3 g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
C. 6.4 g CaC2晶体中所含的离子总数为0.3NA
D. 0.3 mol AgNO3受热完全分解(2AgNO3![]() 2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为0.25NA
2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
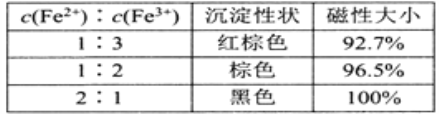
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的![]() Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:_______。当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是________________。
Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:_______。当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是________________。
(2)电化学法也可制备纳米级Fe3O4,用面积为4cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50mA。生成Fe3O4的电极反应为__________。
(3)已知:H2O(1)=H2(g)+![]() O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
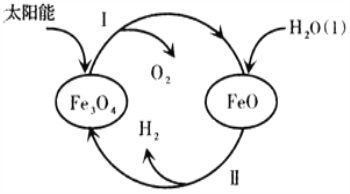
过程I.____________________________________________________。
过程II:3FeO(s)+H2O(1)===H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 二氧化硅是将太阳能转化变为电能的常用材料
B. 玻璃、水晶、玛瑙的主要成分都是硅酸盐
C. 水玻璃可用于生产黏合剂和防火剂
D. 二氧化硅既能跟HF反应,又能跟NaOH反应,因此二氧化硅是两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O===![]() +2Fe2++4H+,Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++ 7H2O,有关说法正确的是
+2Fe2++4H+,Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++ 7H2O,有关说法正确的是
A. 还原性Cr3+>Fe2+>SO2
B. 氧化性Cr2O72->SO2>Fe3+
C. 两个反应中Fe2(SO4)3均作还原剂
D. Cr2O72-能将Na2SO3氧化成Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
A. 新制氯水使红玫瑰变为白玫瑰,说明有Cl2
B. 加入石蕊溶液,溶液变红,说明该溶液一定不含HClO
C. 将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO
D. 光照新制氯水有气泡逸出,该气体一定是O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com