
| A、室温下将CaO、Na2O、Na、NaOH各5克分别投入100克水中,充分搅拌后,所得溶液中溶质的质量分数最小的是CaO |
| B、正戊烷、异戊烷、新戊烷的熔沸点由高到低的顺序为新>异>正 |
| C、AlO2-、HCO3-、Na+、K+等离子不能在水溶液里大量共存 |
| D、将NaHCO3溶液和Na2SO3溶液分别蒸干灼烧,得到的固体都不是原溶质 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
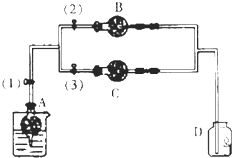 在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接.打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止.
在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接.打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuO→Cu(OH)2 |
| B、Al2O3→Al(OH)3 |
| C、SiO2→H2SiO3 |
| D、Fe→FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
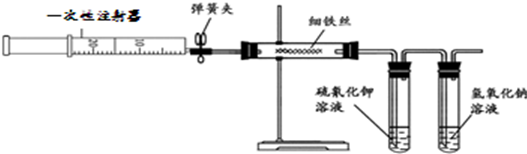
| A、前10min反应的平均速率V(C)=0.10mol/L?min |
| B、10min后向容器中加入A,重新平衡时A的转化率一定大于50% |
| C、恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L |
| D、反应达平衡时B的平衡浓度是1.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
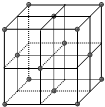 碳有多种同素异形体,常见的有金刚石,石墨,和C60(足球烯)分子,根据报道科研人员应用计算机模拟出结构类似C60的物质N60分子和Si60分子,
碳有多种同素异形体,常见的有金刚石,石墨,和C60(足球烯)分子,根据报道科研人员应用计算机模拟出结构类似C60的物质N60分子和Si60分子,查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | OH- CO32- Cl- NO3- SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com