
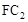 气体有毒,排放到大气中易形成酸雨,写出
气体有毒,排放到大气中易形成酸雨,写出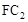 与氧气和水蒸气反应的化学方程式 。
与氧气和水蒸气反应的化学方程式 。 >
> >
> (2分)
(2分)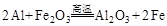 (2分)
(2分) (2分)
(2分)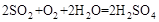 (2分,其他合理答案同样给分)
(2分,其他合理答案同样给分) 、
、 、
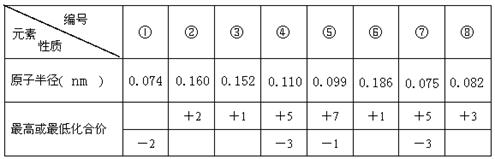
、 ,同一周期内元素的微粒,阴离子半径大于阳离子半径,则原子半径大小为:
,同一周期内元素的微粒,阴离子半径大于阳离子半径,则原子半径大小为: >
> >
> ;
;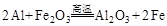 ,若E是非金属元素,其单质在电子工业中有重要应用,故E可为:Si,其氧化物溶于强碱溶液的离子方程式:
,若E是非金属元素,其单质在电子工业中有重要应用,故E可为:Si,其氧化物溶于强碱溶液的离子方程式: .
.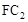 气体有毒,排放到大气中易形成酸雨,则
气体有毒,排放到大气中易形成酸雨,则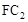 为SO2,SO2与氧气和水蒸气反应的化学方程式为:
为SO2,SO2与氧气和水蒸气反应的化学方程式为: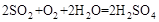


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.碱金属元素中,金属活泼性最强的是Li |
| B.第三周期元素中,原子半径最大的是Cl |
| C.短周期元素最高价氧化物对应的水化物中,酸性最强的是H2SO4 |
| D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ca: 1s22s22p63s23p64s2 | B.Mg2+: 1s22s22p6 |
| C.F—: 1s22s22p5 | D.Br: 1s22s22p63s23p63d104s24p5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Pb属于金属元素 |
| B.Pb的原子半径比Si大 |
| C.Pb的最高价氧化物的水化物是一种较强的酸 |
| D.Pb最高化合价为+4,可以形成氧化物PbO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com