
| A. | 少量碳酸氢铵溶液与足量烧碱溶液混合加热:NH4++OH-$\stackrel{△}{→}$NH3↑+H2O | |
| B. | 氨气通入稀硫酸中:NH3+H+→NH4+ | |
| C. | 稀氨水与稀盐酸混合:NH3?H2O+H+→NH4++H2O | |
| D. | 铜片溶于稀硝酸:3Cu+8H++2NO3-→3Cu2++2NO↑+4H2O |
分析 A.氢氧化钠足量,碳酸氢根离子也参与反应;
B.氨气与稀硫酸反应生成硫酸铵;
C.稀氨水与稀盐酸反应生成氯化铵;
D.铜与稀硝酸反应生成硝酸铜、NO气体和水.
解答 解:A.少量碳酸氢铵溶液与足量烧碱溶液混合加热,反应生成碳酸钠、氨气和水,正确的离子方程式为:2OH-+NH4++HCO3-=CO32-+NH3↑+2H2O,故A错误;
B.氨气通入稀硫酸中,反应生成硫酸铵,反应的离子方程式为:NH3+H+→NH4+,故正确;
C.稀氨水与稀盐酸混合,反应生成氯化铵,反应的离子方程式为:NH3?H2O+H+→NH4++H2O,故C正确;
D.铜片溶于稀硝酸反应的离子方程为:3Cu+8H++2NO3-→3Cu2++2NO↑+4H2O,故D正确;
故选A.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀盐酸:Ba(OH)2+2H+═Ba2++2H2O | |
| B. | 碘化钠溶液和溴水反应:I-+Br2═I2+Br- | |
| C. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 实验室用浓盐酸和MnO2制Cl2:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 向容器中再加入N2可以加快反应速率 | |
| C. | 达到化学反应限度时,生成2 mol NH3 | |
| D. | 达到化学平衡时 N2、H2、NH3的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 3mol/LKCl溶液 | B. | 75mL 2mol/LMgCl2溶液 | ||
| C. | 100mL1mol/LNaCl溶液 | D. | 50mL 3mol/LAlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸保存在棕色带橡胶塞的试剂瓶中 | |
| B. | 漂粉精露置在空气中 | |
| C. | 烧碱溶液可保存在带玻璃塞试剂瓶中 | |
| D. | 可用铝制容器存放浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①正确 | B. | ②③正确 | C. | ①③正确 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 周期表中原子半径最小的元素 |
| T | 最外层电子数是次外层电子数的3倍 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
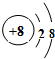 .
.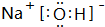 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\overline{v}$(NH3)=0.01 mol/(L•s) | B. | $\overline{v}$(O2)=0.00l0 mol/(L•s) | ||
| C. | $\overline{v}$(NO)=0.00l0 mol/(L•s) | D. | $\overline{v}$(H2O)=0.045 mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com