
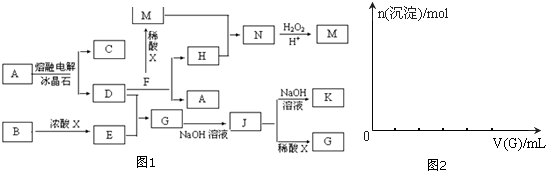
| 3 |
| 2 |
| 3 |
| 2 |
| ||
| 3 |
| ||
| 3 |
| 2 |
| 3 |
| 2 |
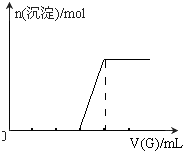 ,故答案为:
,故答案为: .
.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
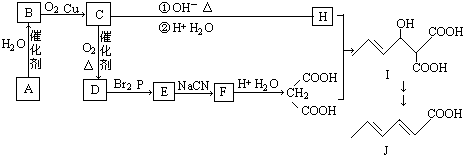
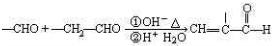
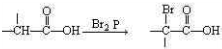
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质 |
| B、人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 |
| C、乙醇可以被氧化为乙酸,二者均能发生酯化反应 |
| D、用氢氧化钠溶液可除去乙酸乙酯中混有的少量的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食用加碘盐可预防碘缺乏症,加碘盐中加的含碘物质是碘单质 |
| B、因为NaCl的水溶液能导电,所以NaCl溶液属于强电解质 |
| C、电解熔融NaCl得到23.0g金属钠时能产生22.4 L氯气(标准状况下) |
| D、37Cl 是氯元素的一种同位素,23Na37Cl中质子数和中子数之比是7:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
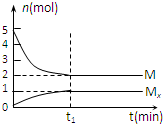 E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A、该反应的化学方程式是2HF?(HF)2 |
| B、时刻,保持温度不变,再充入5molM,重新达到平衡时,将减小 |
| C、平衡时混合气体的平均摩尔质量是33.3g/mol |
| D、M的沸点比同主族下一周期元素的气态氢化物沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
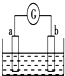 如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )| A、a为负极,是铁片,烧杯中的溶液为稀硫酸 |
| B、b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 |
| C、a为正极,是碳棒,烧杯中的溶液为稀硫酸 |
| D、b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④⑥ | B、①②④⑤ |
| C、②④⑤⑥ | D、③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com