
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 3 | ① | ③ | ④ | ⑨ | ||||
| 4 | ② |
 .
.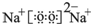 ,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA
,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA分析 由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Al、⑤为Si、⑥为N、⑦为O、⑧为F、⑨为Cl.
(1)同周期自左而右金属性减弱、同主族自上而下金属性增强;同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(2)最高价氧化物对应的水化物中酸性最强的是高氯酸;①和④的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(3)③和⑨形成的化合物为MgCl2,由镁离子与氯离子构成;
(4)元素①和⑦可以形成一种淡黄色物质X为Na2O2;
(5)元素⑥和⑧可形成一种相对分子量为66的共价化合物Y,设其分子式为NxFy,则14x+19y=66,故x=y=2,则Y为N2F2,分子中各原子均达到“8电子稳定结构”,F原子与N原子之间形成1对共用电子对,N原子之间形成2对共用电子对.
解答 解:由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Al、⑤为Si、⑥为N、⑦为O、⑧为F、⑨为Cl.
(1)同周期自左而右金属性减弱、同主族自上而下金属性增强,故上述元素中K的金属性最强;同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Mg>Al>C>N>O,
故答案为:K;Mg;
(2)最高价氧化物对应的水化物中酸性最强的是HClO4;①和④的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:HClO4;Al(OH)3+OH-═AlO2-+2H2O;
(3)③和⑨形成的化合物为MgCl2,由镁离子与氯离子构成,用电子式表示形成过程为: ,
,
故答案为: ;
;
(4)元素①和⑦可以形成一种淡黄色物质X为Na2O2,电子式为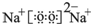 ,含有离子键、共价键,与水发生反应:2Na2O2+2H2O=4NaOH+O2↑,反应中过氧化钠起氧化剂、还原剂左右,各自一半,故转移电子为0.1mol×$\frac{1}{2}$×2×[0-(-1))]=0.1mol,即转移0.1NA个电子,
,含有离子键、共价键,与水发生反应:2Na2O2+2H2O=4NaOH+O2↑,反应中过氧化钠起氧化剂、还原剂左右,各自一半,故转移电子为0.1mol×$\frac{1}{2}$×2×[0-(-1))]=0.1mol,即转移0.1NA个电子,
故答案为: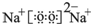 ;离子键、共价键;0.1NA;
;离子键、共价键;0.1NA;
(5)元素⑥和⑧可形成一种相对分子量为66的共价化合物Y,设其分子式为NxFy,则14x+19y=66,故x=y=2,则Y为N2F2,分子中各原子均达到“8电子稳定结构”,F原子与N原子之间形成1对共用电子对,N原子之间形成2对共用电子对,结构式为F-N=N-F,
故答案为:F-N=N-F.
点评 本题考查元素周期表与元素周期律的综合应用,难度不大,侧重考查分析推理能力、常用化学用语,有利于对基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| C. | 用灼烧并闻气味的方法可区别棉麻织物和纯羊毛织物 | |
| D. | 新制Cu(OH)2悬浊液在医院中常用于尿糖的检测 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只用酸性KMnO4溶液 | B. | 只用溴水 | ||
| C. | 只用NaOH溶液 | D. | 用酸性KMnO4溶液和溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物.请回答下列问题:
Ⅰ.Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度时,化学反应速率无论用哪种物质表示,其数值是相等的 | |
| B. | 其他条件不变,降低温度,反应速率减慢 | |
| C. | 其他条件不变时,增大压强,化学反应速率一定加快 | |
| D. | 若增加或减少A的物质的量,反应速率一定会发生明显的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )
诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )| A. | 能与氢气反应 | B. | 能与金属钠反应 | ||
| C. | 能与NaOH溶液反应 | D. | 不能与新制Cu(OH)2悬浊液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于生石灰与水产生的氢氧化钙显碱性,可以使病毒蛋白失去活性 | |
| B. | 饱和石灰水中加入生石灰,在温度不变的情况下,pH不变 | |
| C. | 饱和石灰水中加入生石灰,在温度不变的情况下,溶液中Ca2+的物质的量不变 | |
| D. | 给饱和石灰水溶液升高温度,c(OH-)的浓度降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com