
 bZ(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
| A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/L·min |
| B.根据上图可求得方程式中a:b= 1:3, |
| C.推测在第7min时曲线变化的原因可能是升温 |
| D.推测在第13min时曲线变化的原因可能是降温 |
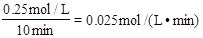 ,A项错误;0~10min内X的变化量是0.25mol/L,Z的变化量是0.5mol/L,所以a:b=1:2,B项错误;7min时从图中可以看出速率加快,但浓度没有改变,所以不是增大压强和增加浓度,有可能是升高温度,C项正确;13min时从图中可以看出X浓度增加,Z的浓度减小,说明平衡逆向移动,不可能是降温,D项错误。答案选C。
,A项错误;0~10min内X的变化量是0.25mol/L,Z的变化量是0.5mol/L,所以a:b=1:2,B项错误;7min时从图中可以看出速率加快,但浓度没有改变,所以不是增大压强和增加浓度,有可能是升高温度,C项正确;13min时从图中可以看出X浓度增加,Z的浓度减小,说明平衡逆向移动,不可能是降温,D项错误。答案选C。

 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源:不详 题型:填空题
 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示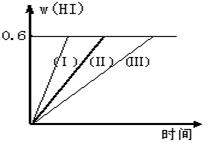
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) ;△H=" —92.4" KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g) ;△H=" —92.4" KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题: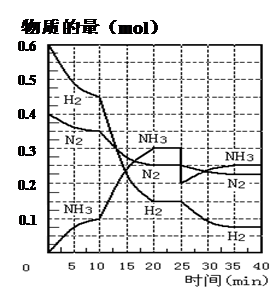
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加NH3物质的量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 (g)+1/2O
(g)+1/2O (g)
(g)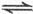 SO
SO (g)△H=-98.32kJ/mol,现有4molSO
(g)△H=-98.32kJ/mol,现有4molSO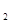 参加反应,当放出314.3kJ热量时,SO
参加反应,当放出314.3kJ热量时,SO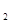 的转化率最接近于
的转化率最接近于| A.40% | B.50% |
| C.80% | D.90% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g) +H2 (g),向2 L密闭容器中通入2 mol CO (g)、1 mol H2O (g),2 min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为________此温度下,该反应的平衡常数为________若往容器中再加入2 mol CO (g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
CO2(g) +H2 (g),向2 L密闭容器中通入2 mol CO (g)、1 mol H2O (g),2 min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为________此温度下,该反应的平衡常数为________若往容器中再加入2 mol CO (g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。 2NO+O2 ΔH>0,反应过程中NO2的浓度随时间变化的情况如下图所示。
2NO+O2 ΔH>0,反应过程中NO2的浓度随时间变化的情况如下图所示。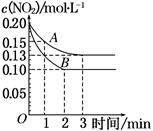
 4NO2(g)+O2(g)
4NO2(g)+O2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.硫酸工业中,反应SO2(g) + 1/2O2(g)= SO3(g) ΔH="-98.3" kJ·mol-1,高压有利于提高原料利用率和生产效率 |
| C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室生产的Cl2进入阳极室 |
| D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)。此反应达到平衡的标志是 ( )
2Z(g)。此反应达到平衡的标志是 ( )| A.容器内气体平均摩尔质量不变 | B.容器内各物质的浓度相等 |
| C.容器内X、Y、Z的浓度之比为1︰2︰2 | D.单位时间消耗0.1mol X同时生成0.2mol Z |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是| 组序号 | 1 | 2 | 3 | 4 | |
| 反应温度/℃ | 225 | 235 | 225 | 235 | |
| 反应前气体的物质的量/mol | CO2 | 0 | 0 | 0.2 | 0.2 |
| CO | 3.0 | 3.0 | 2.8 | 2.8 | |
| H2 | 7.0 | 7.0 | 7.0 | 7.0 | |
| 平衡时CH3OH的体积分数/% | 4.9 | 8.8 | 36.5 | 50.7 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com