
【题目】下列反应,与硫酸型酸雨的形成肯定无关的是( )
A.SO2+2H2S=3S+2H2OB.SO2+H2O![]() H2SO3
H2SO3
C.2SO2+O2![]() 2SO3D.SO3+H2O=H2SO4
2SO3D.SO3+H2O=H2SO4
【答案】A
【解析】
当雨水的pH<5.6时称为酸雨,硫酸型“酸雨”的形成过程可近似地看成是:途经一:排放到空气中的二氧化硫与潮湿空气中的氧气和水蒸气,在空气中粉尘的催化下化合生成硫酸;途径二:是空气中的二氧化硫气体在粉尘做催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨,据此分析解答。
A. SO2+2H2S=3S+2H2O,反应过程中消耗二氧化硫生成单质硫,不能生成硫酸,不是酸雨形成的反应,与硫酸型酸雨的形成肯定无关,故A符合;
B. 酸雨形成过程可以是二氧化硫和水反应生成亚硫酸,亚硫酸和氧气反应生成硫酸,与酸雨形成有关,故B不符合;
C. 空气中的二氧化硫气体在粉尘做催化剂的条件下2SO2+O2![]() 2SO3生成三氧化硫,三氧化硫再与雨水反应SO3+H2O=H2SO4形成酸雨,故C不符合;
2SO3生成三氧化硫,三氧化硫再与雨水反应SO3+H2O=H2SO4形成酸雨,故C不符合;
D. 三氧化硫与雨水反应SO3+H2O=H2SO4形成酸雨,故D不符合;
答案选A。


 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】(I)FeCl3的水溶液呈___(填“酸性”、“碱性”或“中性”),原因是_____(用离子方程式表示);实验室配制FeCl3的水溶液时,需加入______;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(II)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3处
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)某次滴定时的滴定管中的液面如图所示,其读数为_______mL。

(2)根据下列数据:
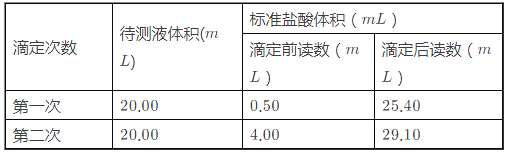
请计算待测烧碱溶液的浓度为______mol/L。
(3)下列实验操作会使实验结果偏高的是_______。
A.锥形瓶用待测液润洗后再注入待测液
B.酸式滴定管未用标准液润洗,便装入标准液
C.酸式滴定管滴定前俯视读数,滴定后仰视读数
D.酸式滴定管滴定前有气泡,滴定后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】规律提炼题组:同分异构体的书写
(1)同温同压下蒸气的密度是H2的43倍的烷烃的分子式________,其中一氯代物只有2种的结构简式为:_______________________。
(2)写出符合下列条件 的所有同分异构体的结构简式_______。
的所有同分异构体的结构简式_______。
a.苯环上只有两个取代基且互为邻位
b.既能发生银镜反应又能发生水解反应
(3)CH2=CHOC2H5的同分异构体,与CH2=CHOC2H5有完全相同的官能团,写出所有可能的结构________。
学法题:通过此题的解答,总结同分异构体常见类型有____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是
A.1 mol苯分子中含有C=C双键数目为3NA
B.标准状况下,11.2L CH3Cl中含有的共价键数目为2NA
C.常温常压下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
D.17 g甲基(﹣14CH3)所含中子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。

(1)请完成下列实验步骤:
①称取3.65 g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中________________(填现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是___________________________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的____________(填字母)连接在________(填装置连接位置)。

(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:

已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂质时,加入H2O2发生反应的离子方程式为___________________。
②加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________。
③加盐酸调整pH为2~3的目的为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )

A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、 F、G、H是周期表中前四周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
H | H是与D相邻的同主族元素,且原子半径:H>D |
(1) B元素符号为________ ,A与C以原子个数比为1:1形成的化合物的电子式为_______ ,用电子式表示C与E形成化合物的过程________ 。
(2) A、C、E所形成简单离子半径由大到小的顺序是____________ ,H的最高价氧化物对应水化物的化学式为_________ ,A、D、H的氢化物的沸点由高到低的顺序为____________________ 。
(3) 非金属性D_________ E(填“大于”或“小于”)。下列事实能证明这一结论的是________ (选填字母序号)。
a.E的熔点低于D
b.氢化物的还原性:D > E
c.最高价氧化物对应的水化物酸性:E > D
d.氢化物的酸性:E >D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲中①②③④表示不同化学元素所组成的化合物,图乙表示由四个单体构成的化合物。以下说法不正确的是( )
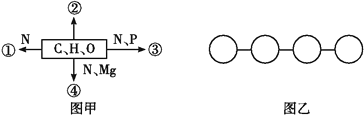
A. 若图甲中的②大量存在于皮下和内脏器官周围等部位,则②是脂肪
B. 若图甲中④能吸收、传递和转换光能,则④可用无水乙醇提取
C. 图乙中若单体是氨基酸,则该化合物彻底水解后的产物中氧原子数增加3个
D. 图乙中若单体是四种脱氧核苷酸,则该化合物彻底水解后的产物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是( )

A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ :酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入 FeCl3 后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com