
分析 将0.50molSO2(g)和0.30molO2(g)放入容积为10L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040mol/L,则:
2SO2(g)+O2(g)?2SO3(g)
起始浓度(mol/L):0.05 0.03 0
变化浓度(mol/L):0.04 0.02 0.04
平衡浓度(mol/L):0.01 0.01 0.04
再根据K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{3})×c({O}_{2})}$计算平衡常数,转化率=$\frac{浓度变化量}{起始浓度}$×100%.
解答 解:将0.50molSO2(g)和0.30molO2(g)放入容积为10L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040mol/L,则:
2SO2(g)+O2(g)?2SO3(g)
起始浓度(mol/L):0.05 0.03 0
变化浓度(mol/L):0.04 0.02 0.04
平衡浓度(mol/L):0.01 0.01 0.04
平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{3})×c({O}_{2})}$=$\frac{(0.04mol/L)^{2}}{(0.01mol/L)^{2}×0.01mol/L}$=1600L/mol,
SO2的平衡转化率=$\frac{0.04mol/L}{0.05mol/L}$×100%=80%,
答:平衡常数为1600 L/mol,二氧化硫的转化率为80%.
点评 本题考查化学平衡计算,难度不大,掌握三段式在化学平衡计算中应用.


科目:高中化学 来源: 题型:解答题
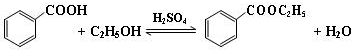
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成较多的白色沉淀 | |
| B. | 排除SO42-以外的其它阴离子及Ag+的干扰 | |
| C. | 形成的沉淀纯度更高 | |
| D. | 排除Ba2+以外的其它阳离子的干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>② | B. | ①<② | C. | ①=② | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水,每转移1mol电子,生成11.2L的H2 | |
| B. | 1molMg与足量的N2完全反应时,转移的电子数为3NA | |
| C. | 精炼铜时,当阳极质量减少6.4g时,电路中转移电子数为0.2NA | |
| D. | 常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
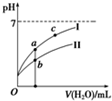 已知:25℃时,下列4种溶液.请回答下列问题.
已知:25℃时,下列4种溶液.请回答下列问题.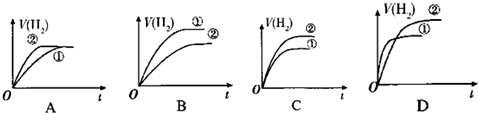
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com