
| A. | c(NH4+)>c(Cl-)>c(OH- )>c( H+ ) | B. | c(Cl-)>c(NH4+)>c( H+ )>c(OH-) | ||
| C. | c(NH4+)+c( H+ )=c(Cl-)+c(OH- ) | D. | c(NH4+)+c( NH3•H2O )=c(Cl-) |
分析 A.NH4Cl溶液中铵根离子水解溶液显酸性;
B.NH4Cl溶液中铵根离子水解溶液显酸性;
C.根据电荷守恒分析;
D.根据物料守恒分析.
解答 解:A.NH4Cl溶液中铵根离子水解溶液显酸性,则c( H+ )>c(OH-),Cl-不水解,所以c(Cl-)>c(NH4+),则溶液中离子浓度关系为c(Cl-)>c(NH4+)>c( H+ )>c(OH-),故A错误;
B.NH4Cl溶液中铵根离子水解溶液显酸性,则c( H+ )>c(OH-),Cl-不水解,所以c(Cl-)>c(NH4+),则溶液中离子浓度关系为c(Cl-)>c(NH4+)>c( H+ )>c(OH-),故B正确;
C.NH4Cl溶液中存电荷守恒为c(NH4+)+c( H+ )=c(Cl-)+c(OH- ),故C正确;
D.铵根离子水解,部分转化为NH3•H2O,则溶液中物料守恒为c(NH4+)+c( NH3•H2O )=c(Cl-),故D正确.
故选A.
点评 本题考查了盐类水解原理、离子浓度大小比较,题目难度不大,注意把握盐的水解原理以及溶液中的守恒关系,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的pH大于盐酸 | |
| B. | 醋酸溶液的pH小于盐酸 | |
| C. | 分别用水稀释相同倍数后,所得溶液中:c(Cl-)═c(CH3COO-) | |
| D. | 两种溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述转化属于分解反应 | B. | 上述反应过程放出大量热 | ||
| C. | 生成的CaO可作氯气的干燥剂 | D. | CaCO3水泥的主要成分之一. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
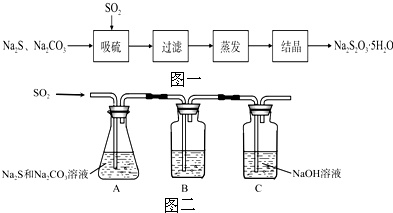
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH. | 有白色沉淀生成,上 层清液pH>10.2 | 样品含NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 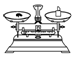 |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离水和四氯化碳的混合物时,四氯化碳从上口倒出 | |
| B. | 用玻璃棒搅拌漏斗中的液体以加快过滤速度 | |
| C. | 可以用酒精萃取碘水中的碘 | |
| D. | 海水通过蒸馏可制得淡水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com