
【题目】按要求回答下列问题:![]()
(1)①反应类型______________
②反应类型________________
(2)现有如下有机物:
① CH3—CH3 ② CH2=CH2 ③ CH3CH2C![]() CH
CH
④ CH3C![]() CCH3 ⑤ C2H6 ⑥ CH3CH=CH2
CCH3 ⑤ C2H6 ⑥ CH3CH=CH2
一定互为同系物的是_______,一定互为同分异构体的是_______(填序号)
(3)人造羊毛的主要成分是聚丙烯腈(丙烯腈:CH2=CH—CN),试写出以乙炔、HCN为原料,两步反应合成聚丙烯腈的化学方程式。
①_________________________________
②_________________________________
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g)![]() CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。

p2 p1 (填“大于”、“小于”或“等于”);
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式_______________。
(4)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=_________。
②0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________。
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国南方,遭遇冰雪灾害时常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为元素周期表前20号元素,X的阳离子和Y的阴离子电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是__________________,该物质中化学键类型是________________,电子式是__________________
(2)D、E元素原子的最外层电子数是其电子层数的2倍,D与Y相邻,则元素D的阴离子结构示意图是________________。D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8电子稳定结构,该分子的电子式为____________________。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质与W的单质加热时生成物中化学键类型为__________,电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可以加快氢气的生成速率。请回答下列问题:
(1) 上述实验中发生反应的化学方程式有:
__________________、_____________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因:__________________;
(3) 实验中现有Na2SO4、MgSO4、 Ag2SO4、 K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是:________;
(4) 要加快上述实验中气体产生的速率,还可以采取的措施有:
_____________________、___________________________(举两种)。
(5) 为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下的一系列的实验。将表中所给的混合溶液分别加到6个盛有过量锌粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需要的时间。
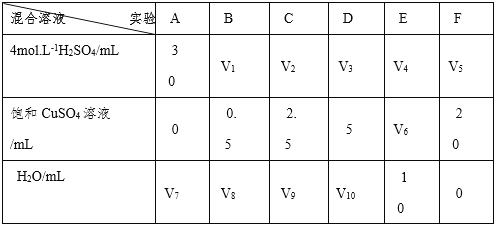
①请完成此实验设计,其中:V1 =____;V6 = ____;V9=____;
②反应一段时间后,实验E中的金属呈____色;
③该同学最后得出结论为:当加入少量硫酸铜溶液时,生成氢气的速率会大大提高,但当加入的硫酸铜溶液超过一定量时,生成氢气的速率反而下降。请分析氢气生成速率下降的主要原因:______________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化是一种生产生活方式。下列行为与“绿色化”理念不相符的是
A. 大力发展清洁能源,减少对传统能源的依赖
B. 生活垃圾分类收集处理,实现资源化再利用
C. 大量生产和贮存石灰,修复酸雨浸蚀的土壤
D. 推广共享单车,倡导低碳、环保的出行方式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下信息:①1 mol N2的共价键断裂吸收946 kJ的能量;1 mol H2的共价键断裂吸收436 kJ的能量;形成1 mol NH3中的化学键释放1 173 kJ的能量。②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
N2(mol·L-1) | H2(mol·L-1) | NH3(mol·L-1) | |
起始时 | 3 | 3 | 0 |
2s末 | 2.6 | 1.8 | 0.8 |
根据以上相关数据回答问题:
(1)用H2表示该反应2 s内的平均反应速率为________
(2)______(填“能”或“不能”)确认该反应2 s末已达化学平衡状态。
(3)写出该反应的化学方程式:
________________________________________________________________________。
(4)氮气和氢气生成氨气的过程______(填“释放”或“吸收”)能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3, 工艺流程简图如下:

回答下列问题:
(1)过程I中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是______。
A.工业制硫酸 B.漂白纸张 C.自来水消毒
(2)过程II中发生的反应______氧化还原反应(填“是”或“不是”)。
(3)过程V中系列操作为_______ (填化学实验基本操作名称)。
(4)①过程I中焙烧As2S3的化学反应方程式为_______________。
②过程IV中生成As2O3的离子反应方程式为_______________。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中
电解含AsO33-的溶液,阳极的电极反应式为______________。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液l00mL。
b.分别移取25.00mL上述溶液,用0.02500 mol·L-1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二图四所示。
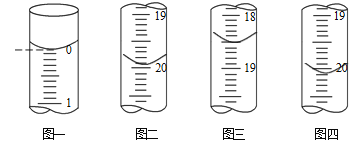
①描述滴定终点的现象_____________________。
②粗产品中As2O3的质量分数为______________ (用含有m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1
O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系

C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com