
| A. | 0.12 mol | B. | 0.11 mol | C. | 0.09 mol | D. | 0.08 mol |
分析 根据n=$\frac{m}{M}$计算1.92gCu的物质的量,n(Cu)=Cu(NO3)2,反应生成Cu(NO3)2与氮的氧化物(NO、NO2中的一种或2种),反应中硝酸起氧化剂与酸性作用,其氧化剂作用的酸性生成氮的氧化物,其酸性作用的硝酸生成Cu(NO3)2,根据氮原子守恒可知n反应(HNO3)=2Cu(NO3)2+n(NO,NO2),以此解答该题.
解答 解:铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,
则n(NO2)+n(NO)=0.05mol,即被还原的硝酸的物质的量为0.05mol,
n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,则生成n(Cu(NO3)2)=0.03mol,
可知表现酸性的硝酸的物质的量为0.03mol×2=0.06mol,
则参加反应的硝酸的物质的量为:0.05mol+0.06mol=0.11mol.
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析、计算能力的考查,难度不大,注意浓硝酸和稀硝酸的性质的不同,明确二氧化氮或一氧化氮和硝酸的关系以及铜与硝酸(表现酸性)的关系式是解本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有18个族 | |
| B. | 第IA族元素称为碱金属元素 | |
| C. | 原子最外层电子数相同的元素,一定属于同一族 | |
| D. | 第3列至第12列的元素全为金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.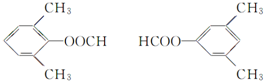 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、④HCHO,其中碳原子采取sp2杂化的分子有①③④
、④HCHO,其中碳原子采取sp2杂化的分子有①③④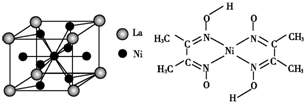
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是一种较弱的化学键 | |
| B. | NH3的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 常温下,Cl2、Br2、I2的状态从气态、液态到固态,主要原因是分子间作用力在逐渐增大 | |
| D. | 最外层能达到稳定结构的微粒只是稀有气体的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com