
| A. | 构成单质的分子中一定含有共价键 | |
| B. | 由非金属元素组成的化合物可能是离子化合物 | |
| C. | 非极性键只存在单质分子里 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
分析 A.稀有气体中不含化学键;
B.铵盐中含离子键;
C.非极性共价键可存在于单质、化合物中;
D.多原子分子中可能含非极性键.
解答 解:A.稀有气体中不含化学键,多原子的分子中一定含共价键,故A不选;
B.铵盐中含离子键,为由非金属元素组成的化合物,故B选;
C.非极性共价键可存在于单质、化合物中,如氧气、过氧化氢、过氧化钠中均存在O-O非极性键,故C不选;
D.多原子分子中可能含非极性键,如H-O-O-H中含极性键和非极性键,故D不选;
故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.


科目:高中化学 来源: 题型:解答题
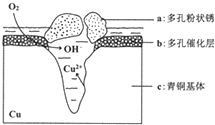 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用PH试纸测得某浓度的Na2CO3溶液的PH值为10.2 | |
| B. | 已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,在定量测定该反应速率时,可用排水法测SO2的体积,计算反应速率 | |
| C. | 蒸发结晶时,将蒸发皿中的溶液蒸干后得到所需固体 | |
| D. | 脂皂化反应后的反应液中加入饱和食盐水并搅拌后,生成的高级脂肪酸钠浮在水面 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu、Si、Zn、Au | B. | Ag、C、Al、Pb | C. | Fe、C、Mg、Pt | D. | Cu、S、Fe、Pt |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知砷(As)元素的原子结构示意图为:
已知砷(As)元素的原子结构示意图为:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-2c}{a}$ | B. | $\frac{2b-4c}{a}$ | C. | $\frac{2b-c}{a}$ | D. | $\frac{b-4c}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 常温常压下,1.06gNa2C03含有的Na+数为0.02NA | |
| C. | 通常状况下,NA个C02分子占有的体积为22.4L | |
| D. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com