
【题目】某校课外小组的同学设计实验用甲烷还原二氧化硫制取单质硫。
(1)甲组同学分别利用如图所示装置制取SO2 和CH4。
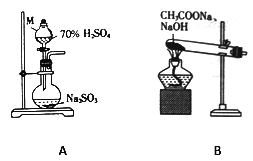
①仪器M的名称为______________。
②用A装置制备SO2,不宜使用稀硫酸,其原因是_________________。
③用B装置制取甲烷的化学方程式为CH3COONa+NaOH![]() CH4↑+Na2CO3,实际实验中常用碱石灰(NaOH 和CaO的混合物)来代替NaOH,原因是____________________________________。
CH4↑+Na2CO3,实际实验中常用碱石灰(NaOH 和CaO的混合物)来代替NaOH,原因是____________________________________。
(2)乙组同学利用甲组制得的CH4和SO2进行实验,并验证产物中除单质硫外还含有CO2。为进行验证,选用甲组实验中的装置A、B和下图所示的装置进行实验,发现G中有淡黄色固体生成,C中澄清石灰水变浑浊。
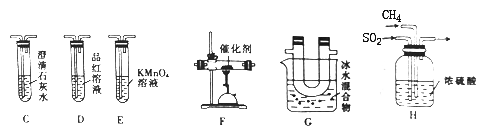
①乙组同学的实验装置中,依次连接的合理顺序为A、B→H→_____→ → → → 。
②E装置的作用是________________,G装置的作用是_______________。
③F装置中发生反应的化学方程式为____________________。
【答案】 分液漏斗 SO2易溶于水 可以减少NaOH对试管的腐蚀 F;G;E;D;C 除去未反应的SO2 将硫蒸气冷却为固态硫 CH4+2SO2![]() 2S↓+CO2+2H2O
2S↓+CO2+2H2O
【解析】(1)①正确答案:分液漏斗。
②二氧化硫易溶于水,损失较大,正确答案:SO2易溶于水。
③NaOH为强碱,能够与玻璃成分中二氧化硅反应,对试管有损害;使用碱石灰,可以减少损害;正确答案:可以减少NaOH对试管的腐蚀。
(2)①二氧化硫与甲烷在催化剂的作用下,生成硫、二氧化碳、水等,硫蒸气在G装置内冷凝变为固体,然后混合气体通过酸性高锰酸钾溶液,除去反应中剩余的二氧化硫气体,用品红检验二氧化硫气体是否除干净,最后用澄清的石灰水检验二氧化碳气体;正确答案:F;G;E;D;C。
②除去二氧化硫气体;将硫蒸气冷却为固态硫;正确答案:除去未反应的SO2;将硫蒸气冷却为固态硫。
③二氧化硫与甲烷在催化剂的作用下,生成硫、二氧化碳、水等;正确答案:CH4+2SO2![]() 2S↓+CO2+2H2O。
2S↓+CO2+2H2O。


科目:高中化学 来源: 题型:
【题目】制备氯化物时,常用两种方法:①用金属与氯气直接化合制得;②用金属与盐酸反应制得.用以上两种方法都可制得的氯化物是( )
A.AlCl3
B.FeCl3
C.FeCl2
D.CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答:
![]()
(1)写出元素符号:A ____;C ___。
(2)B元素位于元素周期表第____周期第____族;其最高价氧化物对应水化物的化学式为____。
(3)A的氢化物的电子式为 _________; A的氢化物与其最高价氧化物的水化物反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需用480mL0.1mol·L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68g硫酸铜,配成500mL溶液
B.称取12.0g胆矾,加入500mL水
C.称取8.0g硫酸铜,加入500mL水
D.称取12.5g胆矾,配成500mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.无色溶液中:Na+、Cl、SO42﹣、Cu2+
B.使紫色石蕊溶液变红的溶液中:Na+、Ca2+、C032﹣、Cl﹣
C.含SO42﹣的溶液中:K+、Ba2+、CI﹣、Br﹣
D.酸性溶液中:Na+、S042﹣、Cl﹣、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )

A、12 g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ
B、该反应的热化学方程式是2C(s)+O2(g)===2CO(g) ΔH=-221 kJ
C、2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
D、该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率![]() x
x
A. ![]() (O2) = 0.01mol·(L·s) –1 B.
(O2) = 0.01mol·(L·s) –1 B. ![]() (NO) = 0.008mol·(L·s) –1
(NO) = 0.008mol·(L·s) –1
C. ![]() (H2O) = 0.006mol·(L·s) –1 D.
(H2O) = 0.006mol·(L·s) –1 D. ![]() (NH3) = 0.002mol·(L·s) –1
(NH3) = 0.002mol·(L·s) –1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用还原铁粉制备二茂铁开辟了金属有机化合物研究的新领域。二茂铁甲酰胺是其中一种重要的衍生物,结构如图所示。

(1)基态Fe原子价层电子排布式是_______。
(2)已知二茂铁甲酰胺熔点是176℃,沸点是249℃,难溶于水,易溶于氯仿、丙酮等有机溶剂。据此可推断二茂铁甲酰胺晶体为_______晶体。
(3)二茂铁甲酰胺中碳原子的杂化方式为_________,H、C、N、O四种元素的电负性由大到小的顺序是_________。
(4)碳、氮元素对应的最简单氢化物分别是CH4和NH3,相同条件下CH4的沸点比NH3的沸点_______(填“高”或“低”),主要原因是_______。
(5)氢、氮、氧三种元素按照4:2:3的原子个数比形成离子化合物。该离子化合物中,阳离子空间构型是_______,1 mol阴离子含有σ键的数目为_______。
(6)氮和铁能形成一种磁性材料,其晶胞如图所示,该磁性材料的化学式为_______。已知晶胞参数为a nm,则该晶胞密度的计算式为ρ=_______g/cm3(用NA表示阿伏加德罗常数的值)。
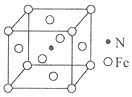
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
B. 6.4gCu与足量浓硝酸反应生成NO2分子数目为NA
C. 1mol淀粉(C6H10O5)n水解后产生的葡萄糖分子数目为NA
D. 标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com