
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水结成冰体积膨胀,密度变小 | |
| C. | NH3易液化 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
分析 A.根据氢化物的热稳定性与非金属的非金属性之间的关系判断,元素的非金属性越强,对应的氢化物越稳定;
B.根据氢键对冰的结构、密度的影响判断,因水分子中含有氢键,一定质量的水,由于氢键的存在,水结成冰体积膨胀、密度变小;
C.氨气分子之间可形成氢键,易液化;
D.H2O,HF,NH3中因为含有氢键,所以其沸点高于同族相邻的其他元素的氢化物.
解答 解:A.非金属性:F>Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,与氢键无关,故A选;
B.氢键具有方向性,氢键的存在迫使四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,所以水结成冰时,体积增大.当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的间隙减小,密度反而增大,故B不选;
C.氨气分子之间可形成氢键,NH3易液化是由于含有氢键的原因,故C不选;
D.水分子与分子间存在氢键,所以常温下H2O为液态,而H2S分子间无氢键,所以常温下为气态,故D不选;
故选A.
点评 本题考查氢键存在的判别,注意氢键是一种分子间的相互作用,不属于化学键,能形成氢键的物质主要有NH3、H2O、HF,氢键比化学键弱,比分子间作用力强,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | CO2+C $\frac{\underline{\;高温\;}}{\;}$ 2CO | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | NaOH+HCl═NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
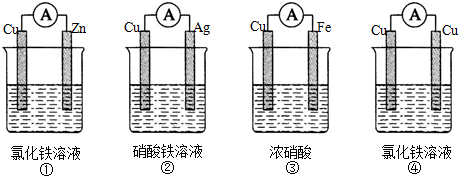
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 | |
| B. | SO2是硫在空气中不完全燃烧的产物,SO3是硫在空气中完全燃烧的产物 | |
| C. | 大气中SO2的主要来源是汽车排出的尾气 | |
| D. | SO2具有漂白性,因而可以使石蕊试液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
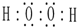 ;肼的结构式
;肼的结构式 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
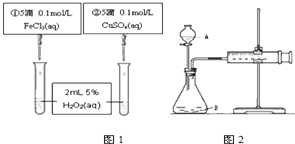
| A. | 图1实验可通过观察产生气泡快慢来比较反应速率的大小 | |
| B. | 若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 | |
| C. | 用图2装置可测定反应产生的气体体积 | |
| D. | 为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>G>M>Y | |
| B. | X、M形成的简单阴离子的还原性:X>M | |
| C. | G与Y形成的化合物一定既能与盐酸反应,又能与烧碱溶液反应 | |
| D. | X、Z分别与Y可形成原子数为1:1的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com