


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”.由化学手册查阅得有关物质的熔、沸点数据如下表.
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”.由化学手册查阅得有关物质的熔、沸点数据如下表.| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤(不要求具体的操作过程) | 预期实验现象和结论 |
| 取少量黑色固体, |
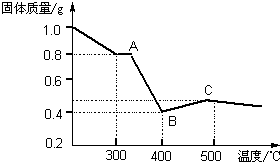 [定量研究]课题组在文献中查阅到,FeC2O4?2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4?2H2O晶体受热分解的化学方程式为:
[定量研究]课题组在文献中查阅到,FeC2O4?2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4?2H2O晶体受热分解的化学方程式为:查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省高三年级第一次联考理综化学试卷(解析版) 题型:实验题
草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸业铁晶体的化学性质, 进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有 (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为 mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:
假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
|
实验步骤(不要求写出具体操作过程) |
预期实验现象和结论 |
|
取少量黑色固体,
|
|
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为: 。

根据图象,如有1.0 g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4 g。某同学由此得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省雅安市高三第三次诊断性考试理综化学试卷(解析版) 题型:实验题
资料:(1)草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色;(2)KMnO4在酸性条件的还原产物为Mn2+。某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成。这说明草酸亚铁晶体具有 (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为 ______mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO;假设二: ;假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
|
实验步骤(不要求具体的操作过程) |
预期实验现象和结论 |
|
取少量黑色固体, |
|
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为: 。
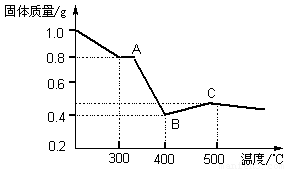
根据图象,如有1.0 g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4 g。某同学由此得出结论:假设一不成立。你是否同意该同学的结论 (填“同意”或“不同意”),并简述理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com