
I.800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g) H2(g)+CO2(g),反应过???中测定的部分数据见下表:
H2(g)+CO2(g),反应过???中测定的部分数据见下表:
反应时间/min | 0 | 2 | 4 | 6 |
n(CO)/mol | 1.20 | 0.90 |
| 0.80 |
n(H2O)/ mol | 0.60 |
| 0.20 |
|
①反应在2 min内的平均速率为v(H2O)=__________;
②800℃时,化学平衡常数K的值为______________;
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率______(填“增大”或“减小”或“不变”)。
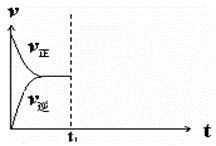
④在恒温恒压密闭容器中通入CO和H2O各1 mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。
II.实验室中利用复分解反应制取Mg(OH)2。实验数据和现象如下表所示(溶液体积均取用1mL):
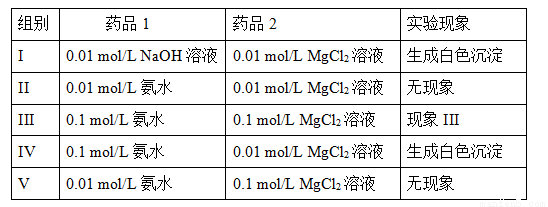
①现象III是 ;
②如果向0.028 mol/L的MgCl2溶液中加入等体积的NaOH溶液,请计算NaOH溶液的浓度至少达到 mol/L时,溶液中开始出现白色沉淀(Ksp(Mg(OH)2)= 5.6×10-12)。
③MgCl2溶液和氨水混合后存在下列化学平衡:
Mg2+(aq) + 2NH3·H2O(aq) 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
Ⅰ ①0.075 mol·L-1·min-1 ②1 ③增大
④
Ⅱ ①生成白色沉淀 ②4×10-5 mol·L-1③K= ;K=
;K=
【解析】Ⅰ.①根据表中数据可知,反应在2 min时CO的物质的量减少了1.20mol-0.90mol=0.30mol。根据方程式可知,水蒸气的物质的量也减少0.30mol,其浓度是0.30mol÷2L=0.15mol/L,所以2min内的平均速率为v(H2O)=0.15mol/2min=0.075 mol·L-1·min-1。
②2min时水蒸气的物质的量是0.30mol,3min时是0.20mol,减少0.10mol,则3min时CO的物质的量是0.80mol。由于4min时CO的物质的量也是0.8mol,这说明反应在3min时达到平衡状态,则
CO(g)+H2O(g) H2(g) + CO2(g)
H2(g) + CO2(g)
起始物质的浓度(mol/L) 0.60 0.30 0 0
变化物质的量浓度(mol/L) 0.20 0.20 0.20 0.20
平衡物质的量浓度(mol/L) 0.40 0.10 0.20 0.20
所以平衡常数K=0.20×0.20/0.40×0.10=1.0
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,增大水蒸气的浓度,平衡向正反应方向进行,因此CO的转化率增大。
④维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,则容器的容积必然增大。由于反应前后体积不变,所以平衡是等效的。但正反应速率增大,逆反应速率减小,而平衡状态不变,因此正确的图像是
 。
。
Ⅱ ①根据表中数据可知,实验Ⅲ和Ⅳ相比,氨水的浓度相同,实验Ⅲ中氯化镁的浓度高于实验Ⅳ中氯化镁的浓度。由于实验Ⅳ中有白色沉淀氢氧化镁生成,所以所以Ⅲ中一定生成白色沉淀氢氧化镁。
②设NaOH溶液的浓度至少达到x,则混合物后溶液中是OH-浓度0.5x。由于混合后溶液中镁离子浓度是0.014mol/L,所以要生成氢氧化镁沉淀,则(0.5x)2·0.014≥5.6×10-12,解得x≥4×10-5mol/L。
③化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,该可逆反应的平衡常数K= 。K=
。K= =
=


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
下列有关说法正确的是
A、氨水稀释后,溶液中 的值减小
的值减小
B、 0.1 mol·L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小
C、电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D、 298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH>0
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:选择题
25℃时,水的离子积常数为Kw,该温度下a mol?L-1的HA与bmol?L-1强碱BOH等体积混合,若恰好完全中和,下列结论中不正确的是
A.混合液中:c(H+)≤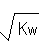
B.混合液中:c(HA)+c(A-)=amol?L-1
C.a=b
D.混合液中:c(H+)+c(B+)=c(OH-)+c(A-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
据中国储能网讯2012年8月23日报道,锂离子电池常见的正极材料主要成分为LiCoO2 ,负极则是特殊分子结构的碳.电解质为能传导Li+的高分子材料,充电时,加在电池两极的电势迫使正极的化合物释出锂离子,嵌入负极分子排列呈片层结构的碳中,这种锂离子电池的电池反应为:Li(C)+LiCoO2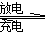 Li2CoO2,下列说法不正确的是
Li2CoO2,下列说法不正确的是
A.该电池属于二次电池
B.充电时LiCoO2 既发生氧化反应又发生还原反应
C.填充在正负极之间的电解质,除了保持稳定,还需要具有良好导电性,减小电池内阻
D.放电过程中Li+向负极移动
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合3 题型:简答题
二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景。
(1)已知H2、CO和CH3OCH3的燃烧热(ΔH)分别为-285.5kJ/mol、-283kJ/mol和-1460.0 kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为: 。
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如下图所示:
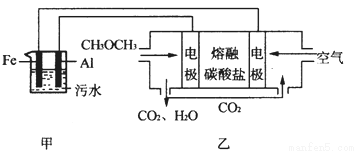
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式 ;下列物质可用做电池熔融碳酸盐的是 。
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式 。
③已知常温下Ksp[Fe(OH)3]=4.0×10-38,电解一段时间后,甲装置中c(Fe3+)= 。
④已知:H2S的电离平衡常数:K1=9.1×10-8、K2=1.1×10-12;H2CO3的电离平衡常数:K1=4.31×10-7、K2=5.61×10-11。测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列选项正确的是
A.发生反应的离子方程式为:CO2+S2-+H2O=CO32-+H2S
B.发生反应的离子方程式为:CO2+S2-+H2O=HCO3-+HS-
C.c(Na+)=2[c(H2S)+c(HS-)+c(S2-)]
D.c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)
E.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:填空题
(14分) 某学生设计了一套验证物质化学性质的实验装置(如图):
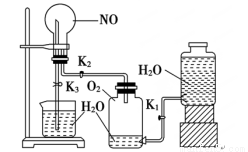
请观察该装置图,完成下列问题:
(1)该实验的目的是
(2)该实验的涉及的化学方程式有
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1、K2)、止水夹(K3)、橡胶管、橡胶塞以及若干玻璃管连件外,还有哪几种(写仪器名称) ____________________。
(4)实验步骤:①按上图连接好仪器装置;②扭开活塞K1和K2,主要现象为 ;
③关闭 ,(填写K1或K2或K3)打开 ,(填写K1或K2或K3), 用手或热毛巾捂住圆底烧瓶,就能使烧瓶产生喷泉。
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
香烟烟雾中含有CO、CO2、SO2、H2O等气体,用①无水CuSO4 ②澄清石灰水③红热CuO ④生石灰 ⑤品红溶液 ⑥酸性高锰酸钾溶液等药品可将其一一检出,检测时香烟烟雾通入药品的正确顺序是( )
A.①⑤②①④③ B.①⑤⑥②④③
C.③④②⑥⑤① D.②⑤①④③⑥
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:填空题
(10分)如图所示3套实验装置,分别回答下列问题。
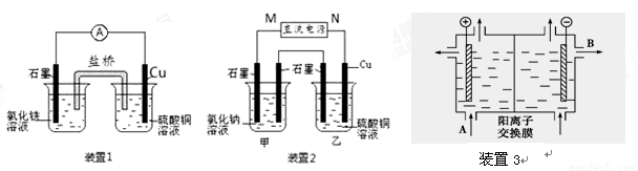
(1)装置1中的Cu是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为 极
② 乙烧杯中电解反应的离子方程式 。
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理装置3所示。
①请写出A、B两处物质的名称:A___________________B____________________
②请写出电解食盐水的离子方程式__________________________________________
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版4.1硅 无机非金属材料练习卷(解析版) 题型:选择题
将含有0.1 mol SiO2的铝、硅混合物分别与足量NaOH溶液、盐酸混合,充分反应后前者可得到11.2 L气体(标准状况),后者可得到6.72 L气体(标准状况),则参加反应的n(HCl)与n(NaOH)之比为( )。
A.1∶1 B.1∶2 C.2∶1 D.3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com