
【题目】Ⅰ.以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请你根据所学习与掌握的知识,按下列要求填空:
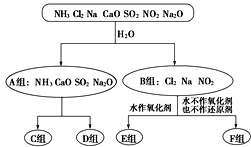
(1)上述第一级分类标准(分成A、B组的依据)是_________________________________。
(2)F组中物质除了Cl2外还有____________(填化学式)。
(3)D组中的氨水呈弱碱性,用电离方程式表示其呈弱碱性的原因:___________________。
(4)用Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,说明理由:____________________。
Ⅱ.某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内:(不要求配平)_______________
![]()
(2)反应中,被还原的元素是__________,还原剂是_______________。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目:_________________
![]()
【答案】 是否发生氧化还原反应 NO2 NH3·H2O![]() NH
NH![]() +OH- 过量NaOH会溶解生成的Al(OH)3沉淀 Au2O3、Na2S2O3、H2O、Na2S4O6、Au2O、NaOH Au Na2S2O3
+OH- 过量NaOH会溶解生成的Al(OH)3沉淀 Au2O3、Na2S2O3、H2O、Na2S4O6、Au2O、NaOH Au Na2S2O3 ![]()
【解析】Ⅰ.(1)氯气、钠、二氧化氮和水反应都有化合价的变化,属于氧化还原反应,而其余物质与水的反应都不是氧化还原反应,所以分类依据为是否发生氧化还原反应。(2)氯气和水反应中氯气既做氧化剂,又做还原剂,水没有变价,钠和水反应时钠做还原剂,水做氧化剂,二氧化氮和水反应,二氧化氮既做氧化剂又做还原剂,所以F组中除了氯气以外还有NO2 。 (3)氨水部分电离生成铵根离子和氢氧根离子,方程式为:NH3·H2O![]() NH4++OH- 。(4)铝离子和过量的氢氧化钠反应时不生成氢氧化铝,而是生成偏铝酸钠,因此不能得到氢氧化铝沉淀。
NH4++OH- 。(4)铝离子和过量的氢氧化钠反应时不生成氢氧化铝,而是生成偏铝酸钠,因此不能得到氢氧化铝沉淀。
Ⅱ.(1)Au2O3为反应物,则反应中Au2O3→Au2O,Au的化合价由+3价变为+1价,则Au元素被还原,Na2S4O6中硫元素平均化合价为+2.5,Na2S2O3中硫元素平均化合价为+2,所以Na2S2O3为反应物,Na2S4O6为生成物,即为氧化产物,由于2Na2S2O3→1Na2S4O6,S硫元素平均化合价由+2价升高为+2.5价,化合价总共升高8×(2.5-2)=4,根据化合价升降相等,反应方程式为Au2O3+4Na2S2O3+2H2O=Au2O+2Na2S4O6+4NaOH;(2)Au元素的化合价降低,被还原,S元素的化合价升高,则Na2S2O3为还原剂;(3)Au2O3+4Na2S2O3+2H2O=Au2O+2Na2S4O6+4NaOH中S失去电子,转移4e-,则电子转移的方向和数目可表示为![]() 。
。
点晴:本题的难点是氧化还原反应分析,把握反应中元素的化合价变化为解答的关键,注意利用化合价、元素守恒判断反应物、生成物,掌握化合价升降法配平氧化还原反应方程式。根据化合价的变化,物质起还原作用,则该物质作还原剂,其化合价要升高,在反应中失去电子,被氧化,发生氧化反应,得到的产物为氧化产物,可以用“升失氧、降得还,剂性一致、其他相反”记忆:反应物所含元素化合价升高,失去电子,发生氧化反应,作还原剂,具有还原性;反应物所含元素化合价降低,得到电子,发生还原反应,作氧化剂,具有氧化性。


科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)装置A中仪器①的名称是__________,装置B中仪器②的名称是__________, 装置D中仪器③的名称是___________。
(2) 从碳酸钙和氯化钠固体混合物中得到纯净氯化钠固体,应选择装置___________(填代表装置图的字母,下同);从海水中获得淡水可选择装置____________;从碘水中分离出I2,应选择装置___________,该分离方法的名称为_________________。
(3)实验室中制取的Fe(OH)3胶体中常常含有杂质Fe3+、Cl-离子。可用________方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO![]() 、SO
、SO![]() 、Cl﹣中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如下图所示:(提示:Al3+与CO
、Cl﹣中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如下图所示:(提示:Al3+与CO![]() 不共存)
不共存)
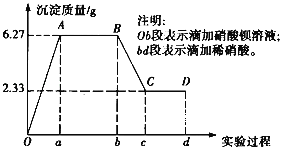
(1)水样中一定含有的阴离子是_____,其物质的量浓度之比为_____.
(2)写出BC段所表示反应的离子方程式:_____.
(3)由B到C点变化过程中消耗硝酸的体积为_____.
(4)试根据实验结果推测K+是否存在?_____(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是_____.(若K+不存在,则不必回答该问).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧可与多种元素形成化合物,设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 7.2 g CaO2晶体中阴离子数目为0.2NA
B. 4.0 g H![]() O中所含电子数为2NA
O中所含电子数为2NA
C. 6.2 g Na2O溶于100 mL水中所得溶液的物质的量浓度为2 mol·L-1
D. 标准状况下,将22.4 L Cl2通入足量水中发生反应,转移电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方法中错误的是 ( )
A. 少量的钠保存在煤油中 B. 氢氟酸保存在玻璃瓶中
C. 新制的氯水保存在棕色玻璃瓶中 D. NaOH溶液保存在带橡皮塞的玻璃瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Na2O2(过氧化钠)与H2O反应的方程式是: 2Na2O2+2H2O =4NaOH+O2↑,将一定质量的Na2O2固体加入足量水中充分反应可生成O2 3.36L标准状况,试计算:
(1)参加反应的Na2O2固体质量为_____________克?
(2)反应后所得溶液加入2 mol/L硫酸溶液_____________毫升恰好被中和?(要求两步均写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尼龙-66是一种重要的合成纤维,它是由己二酸和己二胺[H2N—(CH2)6-NH2]以相等的物质的量在一定条件下聚合而成的,下列叙述中不正确的是( )
A. 尼龙-66的结构简式是
B. 合成尼龙-66的反应属于缩聚反应
C. 合成尼龙-66的反应基础是酯化反应
D. 尼龙-66的长链结构中含有肽键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、镍与铁是同族元素,主要化合价均为+2、+3价,它们的单质及化合物的性质有很多相似之处。试回答下列问题:
(1)氯化铁溶液呈__________ (填“酸”“中”或“碱”)性,原因是___________ (用离子方程式表示)。
(2)将Co3O4与浓盐酸混合,可生成黄绿色气体。写出该反应的化学方程式: ________。
(3)Co2+和Fe3+均可与KSCN溶液发生相似的反应,向CoCl2溶液中加入KSCN溶液,生成某种蓝色离子,该离子中钴元素的质量分数约为20%。则该离子的化学式为___________。
(4)为了比较Fe、Co、Cu三种金属的活动性,某实验小组设计如下实验装置。
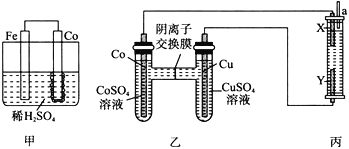
丙装置中充入滴有酚酞的氯化钠溶液,X、Y均为石墨电极。反应一段时间后,可观察到甲装置中Co电极附近产生气泡,丙装置中X极附近溶液变红。可知三种金属的活动性由强到弱的顺序是__________(填元素符号)若起始时装置丙中有1L1.5mol·L1氯化钠溶液,一段时间后,a处收集到1.12LH2(标准状况),忽略溶液体积的变化,装置丙中所有离子的浓度由大到小的顺序为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com