
【题目】下列有关物质的性质和应用对应关系正确的是
A.苏打溶液呈弱碱性,可用作胃酸中和剂
B.氧化铝熔点高,常用于耐高温材料
C.SO2有漂白、杀菌性能,可在食品加工中大量使用
D.晶体硅熔点高、硬度大,是制造太阳能电池和计算机芯片的主要材料
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A. 氧化铁是一种碱性氧化物,常用作红色油漆和涂料
B. 在医疗上碳酸钠、氢氧化铝均可用于治疗胃酸过多
C. Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
D. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在400℃、101 kPa时,NO2(g) +CO(g) ![]() NO(g) + CO2(g) 反应过程的能量变化如下图所示。
NO(g) + CO2(g) 反应过程的能量变化如下图所示。
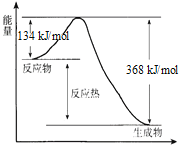
反应过程
(1)该反应是_____________(填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为_____________。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是_____________。
a.浓度 b.压强 c.温度 d.催化剂
(4)反应体系中加入催化剂对反应热是否有影响?____(填“是”或“否”),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
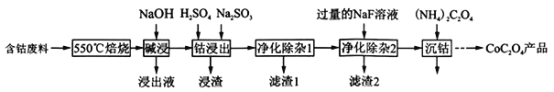
已知:ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱
(1)“550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4) “净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是____________________ (用离子方程式表示);再升温至80~85℃,加入___________溶液,调pH至4.5以达到净化除杂的目的。
(5)“净化除杂2”过程中,若溶液c(Ca2+)=0.01mol/L,使Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5mol/L,此时是否有CaF2沉淀生成________________?(列式计算)[已知Ksp(MgF2) =7.0×10-11、Ksp(CaF2) =1.0×10-10]。
(6)为测定制得样品的纯度,现称取1.000g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017北京]羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:
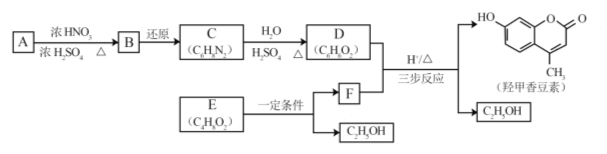
已知: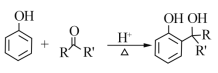
RCOOR'+R'OH![]() RCOOR'+ R'OH(R、R'、R'代表烃基)
RCOOR'+ R'OH(R、R'、R'代表烃基)
(1)A属于芳香烃,其结构简式是______________________。B中所含的官能团是________________。
(2)C→D的反应类型是___________________。
(3)E属于脂类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:__________。
(4)已知:2E![]() F+C2H5OH。F所含官能团有
F+C2H5OH。F所含官能团有![]() 和___________。
和___________。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:
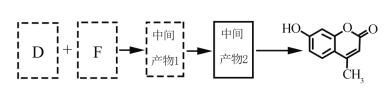
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2 ![]() 2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
A. 等于1.6 mol B. 等于1.2 mol
C. 小于1.2 mol D. 大于1.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.简单离子的半径先减小后增大,卤素离子半径最大
b.元素金属性减弱,非金属性增强
c.最高价氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点逐渐降低
(2)原子最外层电子数是次外层电子数一半的元素名称为____,还原性最弱的简单阴离子是____。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 共价化合物 | |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是________________________________,根据熔点推测Al2O3是___________化合物。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:_____________,在上述由SiCl4(g)制纯硅的反应中,测得每生成0.56 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:_____________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,但可用P2O5干燥的是_________。
a.HI b.NH3 c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各说法中,正确的是
A. 对于2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
B. 热化学方程式中的化学计量数不能用分数表示
C. Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能
D. ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com