
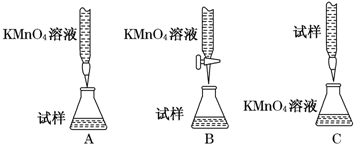
分析 (1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
(2)酸化KMnO4溶液的酸本身不能具有还原性,如果有还原要被高锰酸钾氧化,本身也不能具有强氧化性,所以只能选硫酸;
(3)酸性溶液或强氧化性溶液应用酸式滴定管;
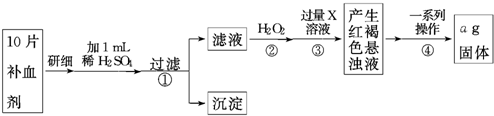
由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量;
(4)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水;
(5)步骤③中X溶液是使Fe3+转化为氢氧化铁沉淀,据此判断;
(6)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量.
解答 解:(1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
故答案为:250mL容量瓶;
(2)酸化KMnO4溶液的酸本身不能具有还原性,如果有还原性要被高锰酸钾氧化,本身也不能具有强氧化性,所以只能选硫酸,故答案为:B;
(3)酸性溶液或强氧化性溶液应用酸式滴定管,故答案为:B;
由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量;
(4)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水,反应离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(5)步骤③中X溶液是使Fe3+转化为氢氧化铁沉淀,所以X溶液是NaOH,故答案为:NaOH;
(6)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
故答案为:灼烧.
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题
 (1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题:
(1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与1molFe反应,转移的电子数为3NA | |
| B. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA | |
| C. | 在标准状况下,Cl2和H2的混合气22.4升,光照后原子总数为2NA | |
| D. | 0.1mol•L-1的FeCl3溶液中含有0.1NA个Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚与碳酸钠反应:2C6H5OH+CO32-→2C6H5O-+CO2↑+H2O | |
| B. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| D. | SO2通入溴水中:SO2+2H2O+Br2═2H++SO42-+2HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) | B. | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | ||
| C. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | D. | c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )所经历的反应的正确顺序是( )
)所经历的反应的正确顺序是( )| A. | ①⑤②③④ | B. | ①②③⑤④ | C. | ②③⑤①④ | D. | ②③⑤①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 2:6:3 | C. | 3:6:2 | D. | 2:1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com