
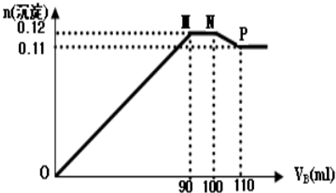
���� ��1��ͼ�е�һ���������ɵij���ΪBaSO4��Fe��OH��3��Al��OH��3���Ҽ���B��Һ90mLʱ��Fe3+��Al3+ǡ�ó�����ȫ��
��2��ͼ�еڶ�������Ϊƽ��ֱ�ߣ����������ʵ���û�����������������Al��OH��3���ܽ��BaSO4�ļ����������������ܽ��Al��OH��3�����ʵ��������ɵ�BaSO4�����ʵ�����ȣ�ͼ�е����������У�����B��Һ100mLʱ��Ba2+ǡ�ó�����ȫ�������Al��OH��3�����ܽ⣬BΪ110mLʱ��������Al��OH��3����ȫ�ܽ⣻
��3��ͼ�е����������У�����B��Һ100mLʱ��Ba2+ǡ�ó�����ȫ�������Al��OH��3�����ܽ⣬BΪ110mLʱ��������Al��OH��3����ȫ�ܽ⣬ͼ�е��Ķ������У�����ΪFe��OH��3��BaSO4��1.1mol����Ϸ���ʽ���㣮
��� �⣺��Һ��ֻ��Fe3+����ȫ�����Ժ�Al3+�ſ�ʼ������
��1��ͼ�е�һ���������ɵij���ΪBaSO4��Fe��OH��3��Al��OH��3���Ҽ���B��Һ90mLʱ��Fe3+��Al3+ǡ�ó�����������110mLB��Һʱ����Һ�еij�����BaSO4��Fe��OH��3��
�ʴ�Ϊ��BaSO4��Fe��OH��3��
��2��ͼ�еڶ�������Ϊƽ��ֱ�ߣ����������ʵ���û�����������������Al��OH��3���ܽ��BaSO4�ļ����������������ܽ��Al��OH��3�����ʵ��������ɵ�BaSO4�����ʵ�����ȣ���Al��OH��3+OH-=AlO2-+2H2O��Ba2++SO42-=BaSO4�����ʼ�������ʣ�n��NaOH��=n��Na2SO4����ͼ�еڶ�������Ϊƽ��ֱ�ߣ����������ʵ���û�����������������Al��OH��3���ܽ��BaSO4�ļ����������������ܽ��Al��OH��3�����ʵ��������ɵ�BaSO4�����ʵ�����ȣ��ʼ�������ʣ�n��NaOH��=n��Na2SO4������η�Ӧ�����ӷ���ʽΪ��Al��OH��3+OH-=AlO2-+2H2O��Ba2++SO42-=BaSO4����
�ʴ�Ϊ��Al��OH��3+OH-=AlO2-+2H2O��Ba2++SO42-=BaSO4����1��1��
��3��ͼ�е����������У�����B��Һ100mLʱ��Ba2+ǡ�ó�����ȫ�������Al��OH��3�����ܽ⣬BΪ110mLʱ��������Al��OH��3����ȫ�ܽ⣬�ܽ��ˣ�0.12-0.11��mol=0.01mol��������10mLB��Һ��Al��OH��3+OH-=AlO2-+2H2O
0.01mol 0.01mol
��c��NaOH��=$\frac{0.01mol}{0.01L}$=1mol/L��
������Na2SO4Ϊ0.01mol����c��Na2SO4��=$\frac{0.01mol}{0.01L}$=1mol/L����������Ӧ���̹�����BaSO4Ϊ0.1L��1mol/L=0.1mol��
ͼ�е��Ķ������У�����ΪFe��OH��3��BaSO4��0.11mol��BaSO4Ϊ0.1mol����Fe��OH��3Ϊ��0.11-0.1��mol=0.01mol��A��c��Fe3+��=$\frac{0.01mol}{0.1L}$=0.1mol/L��
�ʴ�Ϊ��1��0.1��
���� ���⿼�����ӷ���ʽ���йؼ��㣬��Ŀ�ѶȽϴ�ע�����ͼ����ȷ�жϸ��ε����ӷ�Ӧ����ϸ��εĸ������ʵ������м��㣬�����ڿ���ѧ���ķ��������ͼ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��
��
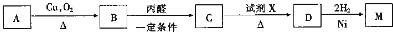
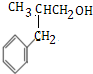 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1Ħ���ᣨCH3COOH����������NA��������ӵ�������� | |
| B�� | NA�������Ӻ�NA������ӵ������ȵ���16��1 | |
| C�� | 28 g����������ԭ����ĿΪNA | |
| D�� | �ڱ�״���£�0.5NA������������ռ���Լ��11.2 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
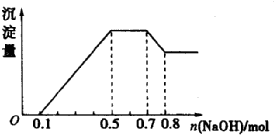 ij��Һ�п��ܺ���H+��NH4+��Mg2+��Al3+��Fe3+��CO32-��SO42-��NO3-�еļ��֣�������п����������ɫ��ζ�����壻������NaOH��Һ��������ɫ�������Ҳ����ij��������������ʵ���֮��Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ�������
ij��Һ�п��ܺ���H+��NH4+��Mg2+��Al3+��Fe3+��CO32-��SO42-��NO3-�еļ��֣�������п����������ɫ��ζ�����壻������NaOH��Һ��������ɫ�������Ҳ����ij��������������ʵ���֮��Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ��Һ��һ��������CO32-�����ܺ���SO42-��NO3- | |
| B�� | ��Һ��n��NH4+��=0.2mol | |
| C�� | C����Һ�е�������ֻ��H+��Mg2+��Al3+ | |
| D�� | n��H+����n��Al3+����n��Mg2+��=1��1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ᷴӦ | B�� | Ũ��������ˮ | ||
| C�� | ̼������ȷֽ� | D�� | NH4Cl��Ba��OH��2•8H2O��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ʯ���ĽṹʽH-C��C-H
��ʯ���ĽṹʽH-C��C-H ��
�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com