
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g) 十H2O (g)?CO2(g) 十 H2 (g);△H<0
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g) 十H2O (g)?CO2(g) 十 H2 (g);△H<0| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
| △c |
| t |
| △c |
| t |
| 0.2-0.08 |
| 4 |
| 0.1×0.1 |
| 0.2×0.1 |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
| A、摩尔是表示物质质量的单位 |
| B、摩尔是表示物质数量的单位 |
| C、摩尔既表示物质微粒数量,又表示物质质量双重意义的单位 |
| D、摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、充电时,电源的正极接蓄电池标“+”的一极,电池上标有“-”的一极发生氧化反应 |
| B、“无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理 |
| C、放电时,在铅酸蓄电池的负极发生还原反应 |
| D、若用此铅酸蓄电池电解饱和NaCl溶液,标准状况下制备1.12LCl2,电池内至少消耗H2SO40.10 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳化铝,黄色晶体,熔点2200℃.熔融态不导电 |
| B、溴化铝,无色晶体,熔点98℃,熔融态不导电 |
| C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙铜中 |
| D、干冰,无色晶体,熔融时不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、由乙二醇制取高分子 是通过加聚反应完成的 是通过加聚反应完成的 |
| B、乙醇在浓硫酸作催化剂,并且加热的条件下一定发生消去反应 |
| C、卤代烃一般来说在NaOH的水溶液中能发生取代反应,而在NaOH的醇溶液中不一定能发生消去反应 |
| D、酯类物质在一定条件下水解一定得到相应的羧酸和醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
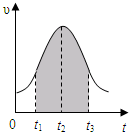 实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O查看答案和解析>>
科目:高中化学 来源: 题型:
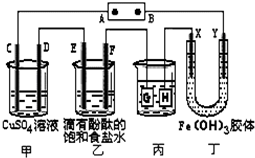 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
科目:高中化学 来源: 题型:
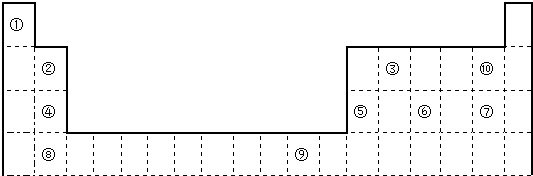
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | |
| C | D |
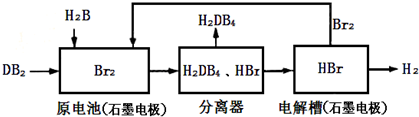
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com