
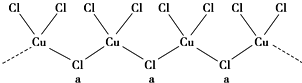
| 1 |
| 8 |
| 1 |
| 2 |
| 63.6g?mol-1 | ||
|


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、沸水中滴入FeCl3饱和溶液:Fe3++3H2O
| ||||
| B、一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑ | ||||
| C、用氢氧化钠溶液吸收过量二氧化碳 OH-+CO2=HCO3- | ||||
| D、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向未知溶液中加入硝酸银溶液,有白色沉淀产生 |
| B、向未知溶液中加入硝酸银溶液,有白色沉淀产生,加入盐酸后.沉淀不消失 |
| C、向未知溶液中加入稀硝酸酸化后,再加入硝酸银溶液,有白色沉淀产生 |
| D、向未知溶液中加入稀盐酸酸化后,再加入硝酸银溶液,有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 小红在帮实验员整理化学试剂时,发现一瓶标签破损的无色溶液,标签严重破损,只能隐约看到一部分(如图).下列说法不正确的是( )
小红在帮实验员整理化学试剂时,发现一瓶标签破损的无色溶液,标签严重破损,只能隐约看到一部分(如图).下列说法不正确的是( )| A、该有机物的分子式一定为C3H6O2 |
| B、在酸性条件下水解生成两种有机产物的相对分子质量可能相等 |
| C、该有机物在碱性条件下可水解更完全 |
| D、该有机物肯定能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式查看答案和解析>>
科目:高中化学 来源: 题型:
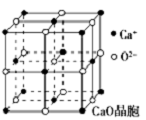 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C
| ||
| ||
 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 (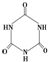 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com