
 向10.00mL0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/LNaOH溶液,溶液PH值变化曲线如图所示.下列说法不正确的是( )
向10.00mL0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/LNaOH溶液,溶液PH值变化曲线如图所示.下列说法不正确的是( )| A、HA是弱酸 |
| B、c点时,V=10.00ml |
| C、b点表示的溶液中:2c(Na+)=c(A-)+c(HA) |
| D、b、c、d点表示的溶液中c(Na+)+c(H+)=c(A-)+c(OH-) |


科目:高中化学 来源: 题型:
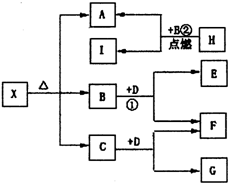 已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.
已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Mg2+、Ba2+、HCO3-、Cl- |
| B、Na+、Cu2+、Ca2+、SO42-、NO3- |
| C、CO32-、Mg2+、NH4+、SO42-、Cl- |
| D、K+、Na+、Cl-、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片与稀盐酸反应 |
| B、灼热的炭与二氧化碳反应 |
| C、甲烷在氧气中燃烧 |
| D、Ba(OH)2?8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、香芹酮化学式为C9H12O |
| B、香芹酮可以发生加成反应、消去反应和氧化反应 |
| C、香芹酮能使酸性KMnO4溶液退色 |
| D、香芹酮分子中有3种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F为前四周期原子序数依次增大的非稀有气体元素.其中:A的一种单质是自然界最硬的物质;B与A同周期且基态原子中s能级与p能级上的电子数相等;C于B同主族;D为同周期电负性最大的元素;E为使用最为广泛的金属;F的基态原子中没有单电子.请回答下列有关问题:
A、B、C、D、E、F为前四周期原子序数依次增大的非稀有气体元素.其中:A的一种单质是自然界最硬的物质;B与A同周期且基态原子中s能级与p能级上的电子数相等;C于B同主族;D为同周期电负性最大的元素;E为使用最为广泛的金属;F的基态原子中没有单电子.请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com