
| 元素原子 | 性质和结构特点 |
| A | 原子中没有成对电子 |
| B | 基态原子中成对的电子的对数与单个电子的数目相同 |
| C | 基态原子的价电子排布式为(n+1)sn(n+1)pn+1 |
| D | C、D位于同周期的相邻元素,电负性:D大于C |
| E | E处于元素周期表的第8列 |
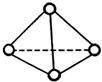 ,31gP4的物质的量为
,31gP4的物质的量为| 31g |
| 124g/mol |


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素 原子个数比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙醛 | B、丁醛 |
| C、3-甲基丁醛 | D、己醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知有机物A、B、C、D、E、F之间的转化关系如图所示.D是常用做汽车发动机的抗冻剂,E为聚合物,F是一种烃,其相对分子量为26.根据信息回答下列问题.
已知有机物A、B、C、D、E、F之间的转化关系如图所示.D是常用做汽车发动机的抗冻剂,E为聚合物,F是一种烃,其相对分子量为26.根据信息回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol/(L?min) |
| B、0.6mol/(L?min) |
| C、0.1mol/(L?min) |
| D、0.3mol/(L?min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com