
【题目】某研究性小组为了探究石蜡油(液态烷烃混合物)的分解产物,设计了如下实验方案。下列说法错误的是
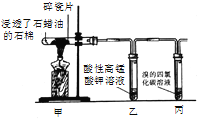
A. 石蜡油分解产物中含有烯烃,不含烷烃
B. 试管乙、丙中溶液均褪色,分别发生氧化反应、加成反应
C. 碎瓷片有催化和积蓄热量的作用
D. 结束反应时,为防止倒吸,先撤出导管,再停止加热
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一块表面已部分被氧化为氧化钠的金属钠样品5.4g,将其投入94.7g 水中,放出1120mL H2(标准状况下)。
(1)请写出该样品放入水中时发生的反应的化学方程式:_______。滴加酚酞后溶液颜色_______,由此可知溶液呈_______ (“酸性”“碱性” 、 或“中性”)。
(2)样品中含金属钠_______g。
(3)所得的溶液的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由S、Cl及Fe、Co、Ni等过渡元素组成的新型材料有着广泛的用途,回答下列问题:
(1)钴元素基态原子的电子排布式为_______,P、S、C1的第一电离能由大到小顺序为________。
(2)SCl2分子中的中心原子杂化轨道类型是_______,该分子空间构型为________。
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为_______。Ni(CO)4中σ键与π键个数比为______,已知:Ni(CO)4熔点-19.3℃,沸点43℃,则Ni(CO)4为_______晶体。
(4)已知NiO的晶体结构如图1所示。
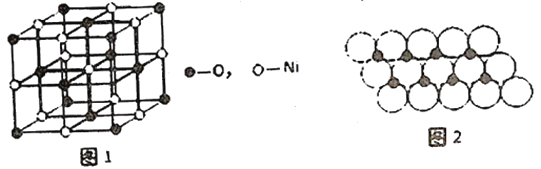
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的____体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO____NiO(填“>”、“<”或“=”),理由是_______________。
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图2),己知O2-的半径为am,每平方米面积上分散的NiO的质量为______g。(用a、NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从石油裂解中得到的1,3-丁二烯可进行以下多步反应,得到氯丁橡胶和富马酸。

(1)B的名称为2-氯-1,4-丁二醇,请你写出B的结构简式____________________。
(2)请你写出第①步反应的化学方程式:________________________________________。
(3)反应①~⑥中,属于消去反应的有______________________________。有机合成中路线和步骤的选择非常重要。
(4)有机合成中的路线和步骤选择非常重要,若将第②步与第③步的顺序调换,则B结构将是____________________。
(5)如果没有计算③和⑥这两步,直接用KMnO4/H+处理物质A,导致的问题是:____________________________________________________________。
(6)某种有机物的分子式为C2H4O4,它的分子中所含官能团的种类、数目均与富马酸相同,不考虑顺反异构,它可能的结构有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.铜丝能导电,所以铜是电解质
B.固体氯化钠不导电,所以氯化钠不是电解质
C.SO3溶于水能导电,所以SO3是电解质
D.氯化氢水溶液能导电,所以氯化氢是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员在探究如何降低大气中氮氧化物与碳氧化物的含量方面做出了巨大贡献,并取得了显著的成绩。
(1)反应2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H<0,可用于净化汽车尾气,已知570K时该反应的反应速率极慢,平衡常数极大。提高尾气净化效率的最佳途径是下列措施中的______(填标号);若要净化汽车尾气的同时提高该反应的速率和NO的平衡转化率,且只改变一个反应条件,则应采取的措施是____(填标号)。
2CO2(g)+N2(g) △H<0,可用于净化汽车尾气,已知570K时该反应的反应速率极慢,平衡常数极大。提高尾气净化效率的最佳途径是下列措施中的______(填标号);若要净化汽车尾气的同时提高该反应的速率和NO的平衡转化率,且只改变一个反应条件,则应采取的措施是____(填标号)。
a.研制、使用高效催化剂 b.升高温度
c.增大压强 d.用碱溶液吸收CO2
(2)已知:△H=产物的总摩尔生成焓-反应物的总摩尔生成焓。25℃,101kPa时,NO、CO、CO2、N2的摩尔生成焓分别为+90.3kJ·mol-1、-110.5kJ·mol-1、-393.5kJ·mol-1、0 kJ·mol-1,则2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)的△H=___________________。
2CO2(g)+N2(g)的△H=___________________。
(3)某科研小组根据反应2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)来探究反应物起始时的碳氮比
2CO2(g)+N2(g)来探究反应物起始时的碳氮比![]() 对污染物去除率的影响。T℃时,向体积为1L的恒容密闭容器中充入总物质的量为4mol的NO和CO混合气体,并加入一定量的固体催化剂进行反应,实验测得平衡体系中气体组分转化率和氮气的体积分数的变化如图所示。
对污染物去除率的影响。T℃时,向体积为1L的恒容密闭容器中充入总物质的量为4mol的NO和CO混合气体,并加入一定量的固体催化剂进行反应,实验测得平衡体系中气体组分转化率和氮气的体积分数的变化如图所示。

①根据图像推测转化率1曲线表示的是____________(填“CO”或“NO”)。
②A点时,![]() =_______________,氮气的体积分数为____________;T℃时,反应的平衡常数K=________________。
=_______________,氮气的体积分数为____________;T℃时,反应的平衡常数K=________________。
(4)已知:△G=△H-T△S;②△G=-RTlnK,其中K为反应的标准平衡常数,气体常数R=8.314×10-3kJ·mol-1·K-1。298K、101kPa时,2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)的△G=-687.6kJ·mol-1,该反应的△G>△H,原因是_________________。298K时,该反应的标准平衡常数K=___________(用含e的指数表示,列出计算式即可)。
2CO2(g)+N2(g)的△G=-687.6kJ·mol-1,该反应的△G>△H,原因是_________________。298K时,该反应的标准平衡常数K=___________(用含e的指数表示,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里将NaClO3和Na2SO3按质量之比为71∶42倒入烧瓶中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( )
A. Cl2 B. Cl2O C. ClO2 D. Cl2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com