
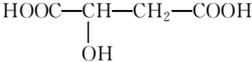
分析 由结构可知分子式,分子中含-COOH、-OH,结合羧酸、醇的性质来解答.
解答 解:(1)苹果醋中含有的官能团的名称是羟基、羧基,故答案为:羟基;羧基;
(2)苹果醋的分子式为C4H6O5,故答案为:C4H6O5;
(3)-OH、-COOH均与Na反应生成氢气,则1mol苹果醋与足量金属钠反应,能生成标准状况下的氢气为1.5mol×222.4L/mol=33.6L,故答案为:33.6;
(4)A.含-COOH,与NaOH溶液反应,故A正确;
B.含-COOH,具有酸性,与石蕊溶液作用,故B正确;
C.含-OH,与乙酸在一定条件下酯化,故C正确;
D.含-COOH,与乙醇在一定条件下酯化,故D正确;
故答案为:ABCD.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意羧酸、醇的性质及应用,题目难度不大.


科目:高中化学 来源: 题型:多选题
 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热效应△H<0 | |
| D. | 反应物的总能量高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 电解熔融氧化铝:2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ | |
| C. | NaHCO3溶液与稀H2SO4反应:HCO3-+H+═H2O+CO2↑ | |
| D. | 向Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA | |
| B. | 标准状况下,2.24 L Cl2与氢氧化钠溶液完全反应转移电子数为0.1NA | |
| C. | 1 mol NaCl中含有6.02×1023个NaCl分子 | |
| D. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中金属共失去电子0.1mol | |
| B. | 合金中,铜的质量为2.8g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5mol•L-1的NaOH溶液60mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 解释或结论 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,溶液褪色 | SO2具有漂白性 |
| B | 将NaHCO3和NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| C | 某钾盐溶于盐酸,产生无色无味气体,该气体通入 澄清石灰水,有白色沉淀出现 | 该钾盐是K2CO3 |
| D | NaI溶液$\stackrel{30%H_{2}O_{2}溶液}{→}$$\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | 酸性条件下H2O2的氧化性比I2强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com