
合成氨工业对化学工业和国防工业具有重要意义,对农业生产起着重要作用。
(1)已知:N2(g)+O2(g)=2NO(g) △H1
H2(g)+1/2O2(g)=H2O(1) △H2
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3
N2(g)+3H2(g)?2NH3(g) △H4<0
则△H4= (用含△H1、△H2、△H3的代数式表示)。
(2)在其他条件相同时,分别测定合成氨反应中N2的平衡转化率随压强变化的曲线如下图A、B所示,其中正确的是 (填“A”或“B”),其判断理由是 。

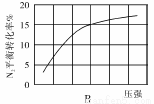
(3)在体积为2L的密闭容器中按物质的量1:3的比例充入N2、H2,进行下列四组合成氨实验:
组别 | 温度 | N2起始量/mol | N2的物质的量/mol | ||||||
5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
①实验Ⅰ前10秒的平均速率v(NH3)= mol·L-1·s-1,T1温度下合成氨反应的平衡常数K= (列出计算式)。
②与实验Ⅰ相比,实验Ⅱ改变了一个条件,该条件可能是 。
③与实验I相比,实验Ⅲ中N2的平衡转化率 (填“增大”、“减小”或“不变”),平衡常数K (填“增大”、“减小”或“不变”)。
④实验Ⅲ与实验Ⅳ的反应条件温度不同,则T1 (填“大于”、“小于”或“等于”)T2,原因是 。
科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:选择题
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法中正确的是( )
A.KClO3在反应中是还原剂
B.1molKClO3参加反应,在标准状况下能得到22.4L气体
C.反应中H2C2O4既不是氧化剂也不是还原剂
D.1molKClO3参加反应有2mol电子转移
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上开学测化学试卷(解析版) 题型:选择题
巴豆酸是一种对胃肠道有强烈刺激性、对呼吸中枢和心胜有麻痹作用的有机酸,其结构简式为CH3-CH=CH-COOH,现有①氯化氢 ②溴水 ③纯碱溶液 ④乙醇 ⑤酸性高锰酸钾溶液试根据其结构特点判断在一定条件下能与巴豆酸反应的物质是( )
A.只有②④⑤ B.只有①③④ C.只有①②③④ D.全部
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:实验题
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产重铬酸钾。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图所示。反应器中涉及的主要反应是:6 FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O
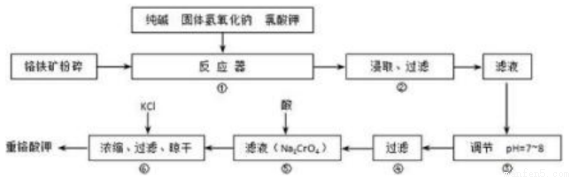
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐。写出氧化铝与碳酸钠反应的化学方程式:______________________。
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式:_________________。
(3)步骤③中测定pH值的操作为:________________。
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
操作步骤 | 实验现象 | 结论 |
①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置。 | 试管中仍有固体物质 | 固体为_____________ |
②操作①后,过滤;在滤液中加入过量的____________。 | 有红褐色沉淀产生 | 沉淀为Fe (OH)3 |
③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2。 | _____________ | 生成物为Al (OH)3; |
(5)称取重铬酸钾(其式量为294)试样2.5000 9配成250 mL溶液,用移液管取出25. 00 mL于碘量瓶中,加入10 mL 2 mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol/L Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需________和________________。
②若实验中共用去Na2S2O3标准溶液40. 00 mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)____________。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:选择题
下列有关放热反应、吸热反应的说法不正确的是
A.吸热反应的发生都需要加热,放热反应在常温下一定容易发生
B.若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应
C.由“C(石墨)=C(金刚石)是吸热反应”可知石墨比金刚石稳定
D.不管是吸热反应还是放热反应,升高温度,反应速率均增大
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三第一次摸底化学试卷(解析版) 题型:选择题
聚甲基丙烯酸酯( )的缩写代号为PMMA,俗称有机玻璃。下列说法中错误的是
)的缩写代号为PMMA,俗称有机玻璃。下列说法中错误的是
A.聚甲基丙烯酸甲酯属于有机干分子合成材料
B.聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n
C.合成PMMA的单体是甲基丙烯酸和甲醇
D.甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]中碳原子可能都处于同一平面
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:实验题
KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:
①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得深紫色的KMnO4产品。
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒机理与下列物质相似的是 (填字母)。
A.75%酒精 B.双氧水
C.苯酚 D.“84”消毒液(NaClO溶液)
(2)写出第②步中发生反应的离子方程式 。
(3)第③步中从滤液中获得KMnO4晶体的方法是 、 、过滤、洗涤、干燥。
(4)取上述制得的KMnO4产品2.0000g,溶于水配成250ml溶液,取出25.00ml于碘量瓶中,加入稀硫酸和足量碘化钾并放于暗处5min左右,然后加入适量水和数滴淀粉溶液作指示剂,用0.2500mol/L标准Na2S2O3溶液进行滴定(发生反应I2+2S2O32-=2I-+S4O62-,杂质不参加反应),滴定至终点消耗Na2S2O3溶液20.00ml。
①滴定终点的现象是 。
②计算KMnO4产品的纯度。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
《中华人民共和国大气污染防治法》于2016年1月1日起实施。为保护和改善大气环境,下列做法不应该提倡的是
A.用CO2合成聚碳酸酯等可降解塑料,减少白色污染
B.研究采煤、采油新技术,尽量提高其产量以满足工业生产快速发展的需求
C.大力推广农作物的生物防治技术,以减少农药的使用
D.研发光电转换材料,充分利用太阳能
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省汕头市高二上学期入学考试化学试卷(解析版) 题型:选择题
下列排列顺序正确的是
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4④结合质子能力:OH->CH3COO->Cl-
A. ①③ B. ②④ C. ①④ D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com