
| A. | 标准状况下,1 mol NO与0.5 mol O2混合后气体的体积为22.4 L | |
| B. | 1L 0.5 mol•L-1 NaF溶液中含有的F-数目为0.5NA | |
| C. | 7.8g Na2S和Na2O2晶体混合物中共含有0.1NA个阴离子 | |
| D. | 12g石墨晶体中正六边形的数目为3NA |
分析 A.二氧化氮气体中存在平衡:2NO2?N2O4;
B.氟离子为弱酸根离子,水溶液中部分水解;
C.根据过氧化钠和硫化钠的摩尔质量都是78g/mol,且过氧化钠中的阴离子为过氧根离子计算含有的阴离子数目;
D.根据每个正六边形中六个碳原子,而每一个点是三个六边形公用计算出含有的正六边形的数目;
解答 解:A.1 mol个NO分子和0.5mol个O2分子混合后恰好完全反应生成1mol二氧化氮,但二氧化氮气体中存在平衡:2NO2?N2O4,导致分子个数减少,故气体物质的量小于1mol,气体的体积小于22.4 L,故A错误;
B.氟离子为弱酸根离子,水溶液中部分水解,所以1L 0.5 mol•L-1 NaF溶液中含有的F-数目小于0.5NA,故B错误;
C.7.8g Na2S和Na2O2的混合物的物质的量为0.1mol,含有阴离子的物质的量为0.1mol,含有的阴离子数为0.1NA,故C正确;
D.每个正六边形所占有的碳原子数为6,而每一个C都是3个六边形公用的,每个正六边形含有的C原子数为:6×$\frac{1}{3}$=2,12gC的物质的量为1mol,可以形成的正六边形为:$\frac{1mol}{2}$=0.5mol,构成的正六边形的数目为0.5NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的应用及有关计算,明确各个物理量关系是解本题关键,注意石墨晶体的结构,题目难度不大.


科目:高中化学 来源: 题型:解答题

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7g | B. | 8.1g | C. | 5.4g | D. | 10.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
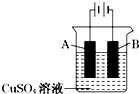 钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题.
钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
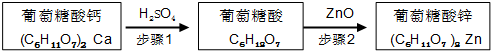
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
 请回答下列问题:
请回答下列问题: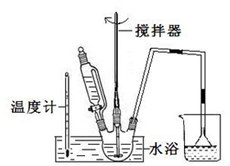
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com