
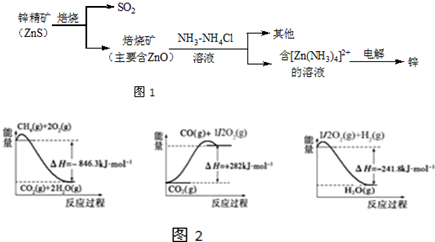
分析 (1)根据价层电子对互斥理论确定分子空间构型;
(2)焙烧中硫化锌与氧气在高温下反应生成氧化锌和二氧化硫;
(3)ZnO属于两性氧化物,ZnO与NaOH溶液反应生成Na2ZnO2;
(4)SO2可用Ba(NO3)2溶液吸收,发生氧化还原反应生成一氧化氮和硫酸钡;
(5)二氧化氮具有强的氧化性性与二氧化硫在碱性环境下反应生成硫酸根离子和亚硝酸根离子和水;
(6)电解过程中析出锌的电极上[Zn(NH3)4]2+ 得电子发生还原反应;
(7)由图2可知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol ①
CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+282KJ/mol ②
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol ③
依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(8)依据化学方程式和平衡常数概念写出表达式,注意尿素是固体;根据化学平衡三段式列式计算平衡浓度,计算平衡常数.
解答 解:(1)NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥型,
故答案为:三角锥型;
(2)由题中信息可知,锌精矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌,反应的化学方程式为:2ZnS+3O2$\frac{\underline{\;高温\;}}{\;}$2ZnO+2SO2;
故答案为:2ZnS+3O2$\frac{\underline{\;高温\;}}{\;}$2ZnO+2SO2;
(3)ZnO属于两性氧化物,ZnO与NaOH溶液反应生成Na2ZnO2,反应的化学方程式:2NaOH+ZnO=Na2ZnO2+H2O;
故答案为:2NaOH+ZnO=Na2ZnO2+H2O;
(4)SO2可用Ba(NO3)2溶液吸收,发生氧化还原反应生成一氧化氮和硫酸钡,反应的离子方程式为3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+;
(5)二氧化氮具有强的氧化性性与二氧化硫在碱性环境下反应生成硫酸根离子和亚硝酸根离子和水,离子方程式:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O;
故答案为:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O;
(6)电解过程中析出锌的电极上[Zn(NH3)4]2+ 得电子发生还原反应,电极反应式为[Zn(NH3)4]2++2e-=Zn+4NH3↑,
故答案为:[Zn(NH3)4]2++2e-=Zn+4NH3↑;
(7)由图2可知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol ①
CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+282KJ/mol ②
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol ③
将①+②-③×3可得:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=(-846.3KJ/mol)+(+282KJ/mol )-(-241.8KJ/mol )×3=+161.1 kJ•mol-1,所以CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+161.1 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+161.1 kJ•mol-1;
(8)2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g).依据化学方程式和平衡常数概念写出平衡常数K=$\frac{c({H}_{2}O)}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,反应达到平衡时CO2的转化率为50%,消耗二氧化碳浓度0.02mol/L×50%=0.01mol/mol;
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)
起始量(mol/L) 0.04 0.02 0 0
变化量(mol/L) 0.02 0.01 0 0.01
平衡量(mol/L) 0.02 0.01 0 0.01
K=$\frac{c({H}_{2}O)}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$=$\frac{0.01}{0.02{\;}^{2}×0.01}$=2500,
故答案为:2500.
点评 本题为综合题,考查了热化学方程式、方程式、离子方程式的书写,化学平衡常数的计算,电解池电极反应式的书写,明确盖斯定律计算反应热的方法、化学平衡常数表达式、电解池工作原理是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 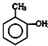 甲基苯酚 甲基苯酚 | |
| B. | 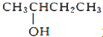 2-羟基丁烷 2-羟基丁烷 | |
| C. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| D. | CH2=CH-CH=CH-CH=CH2 1,3,5-己三烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566 kJ/mol | |
| B. | 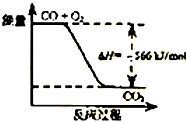 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NH3通入AgN03溶液中,再加几滴葡萄糖溶液,加热后有银镜产生,证明葡萄糖有氧化性 | |
| B. | 配制Fe(N03)2溶液时,向Fe(N03)2溶液中加几滴稀硫酸,以防止Fe(N03)2发生水解 | |
| C. | 向NaI溶液中加入少量CCl4振荡,未见蓝色,说明NaI没有变质 | |
| D. | 剪取一小块铝箔,投入到NaOH溶液中,观察到在被剪断处先产生气体,说明铝在空气中易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液化石油气(LPG)的主要成份是碳氢化合物 | |
| B. | 氮氧化物和氟氯烃的排放引发臭氧空洞 | |
| C. | CHCl3不存在同分异构体,可以证明甲烷是以碳原子为中心的正四面体结构 | |
| D. | 沸点:正丁烷>异丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴、阳离子通过静电吸引形成的强烈的相互作用 | |
| B. | 只由非金属元素组成的化合物不可能是离子化合物 | |
| C. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| D. | 只有活泼金属与活泼非金属之间才能形成离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com