
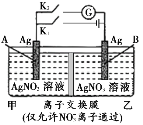
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3 mol/L的AgNO3溶液,乙池为1 mol/L的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是
A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
B.断开K1、闭合K2,当转移0.1 mol e-时,乙池溶液质量增加17.0 g
C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大
【答案】C
【解析】
断开K1,闭合K2后,形成浓差电池,甲池为3 mol/L的AgNO3溶液,乙池为1 mol/L的AgNO3溶液,Ag+浓度越大离子的氧化性越强,可知A为正极,发生还原反应,B为负极,发生氧化反应,NO3-向负极移动;闭合K1,断开K2,为电解装置,与电源正极相连的B极为阳极,阳极金属银被氧化,阴极A析出银,NO3-向阳极移动,乙池浓度增大,甲池浓度减小,据此解答。
A. 断开K1,闭合K2后,形成浓差电池,当两池银离子浓度相等时,反应停止,电流计指针将归零,A正确;
B. 断开K1,闭合K2后,形成浓差电池,A为正极,发生反应:Ag++e-=Ag,B为负极,发生反应为:Ag-e-=Ag+,当转移0.1 mol电子,有0.1 mol NO3-由甲池通过离子交换膜进入乙池,所以乙池增加的质量是10.8 g+6.2 g=17.0 g,B正确;
C. 闭合K1,断开K2后,乙池中的B极为电解池的阳极,银失电子发生氧化反应,质量减小,C错误;
D. 闭合K1,断开K2后,装置为电解池,与电源正极相连的B是阳极,阳极金属银被氧化产生银离子,NO3-向阳极移动,则乙池硝酸银溶液的浓度增大,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定环境中能大量共存的是( )
A.在 =1013的溶液中:NH4+、Ca2+、Cl-、K+
=1013的溶液中:NH4+、Ca2+、Cl-、K+
B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、K+
C.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
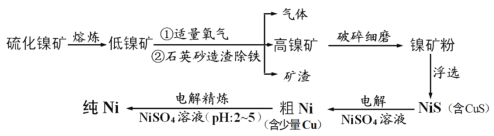
【题目】元素Ni用途广泛,工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:
已知:①电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2 -2e-= 2H+ E=0.00V; Cu-2e- =Cu2+ E=0.34V;
Fe -2e-= Fe2+ E=-0.44V; Ni-2e-=Ni2+ E=-0.25V
②常温下溶度积常数 Ksp(NiS)=1.07×10-21; Ksp(CuS)=1.27×10-36
(1)可用光洁的镍丝代替铂丝蘸取化学试剂在焰色反应实验中灼烧,原因是_________。
(2)就制备高镍矿的相关问题请回答:
①通入氧气时控制适量的目的是________________。
②已知矿渣能使酸性高锰酸钾溶液褪色,原因是__________________。
(3)电解制粗镍时阳极发生的主要电极反应式___________________。
(4)电解精炼镍的过程需控制pH为2~5,试分析原因__________________。
(5)工业生产中常用加NiS的方法除去溶液中的Cu2+,若过滤后溶液中c(Ni2+) 为0.107 mol/L,则滤液中残留的c(Cu2+)为________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如下(Ce为铈元素):

下列说法错误的是
A.Na2S2O4中S元素的化合价为+3
B.装置Ⅱ消耗36 g 水生成4 NA个H+(NA代表阿伏伽德罗常数)
C.装置Ⅲ用甲烷燃料电池进行电解,当消耗24 g 甲烷时,理论上可再生10 mol Ce4+
D.装置Ⅳ获得粗产品NH4NO3的实验操作依次为蒸发浓缩、冷却结晶、过滤、洗涤等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛,其实验步骤为:①将三颈烧瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴(Br2),保温反应一段时间,冷却。②将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液,有机相用10%NaHCO3溶液洗涤。③经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。④减压蒸馏有机相,收集相应馏分。(注:MgSO4固体是有机化工生产中常用的一种干燥剂。)

下列说法错误的是
A.步骤①中使用1,2-二氯乙烷的目的是作催化剂,加快反应速率
B.可在该实验装置的冷凝管后加接一支装有无水MgSO4的干燥管,提高实验效果
C.步骤②中有机相用10%NaHCO3溶液洗涤可除去HCl及大部分未反应的Br2
D.步骤④中使用减压蒸馏有机相是因为间溴苯甲醛高温下容易挥发逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家们致力于消除氮氧化物对大气的污染。回答下列问题:
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH,该反应共有两步第一步反应为2NO(g)
2NO2(g) ΔH,该反应共有两步第一步反应为2NO(g)![]() N2O2(g) ΔH1<0;请写出第二步反应的热化学方程式(ΔH2用含ΔH、ΔH1的式子来表示):_______________________________________。
N2O2(g) ΔH1<0;请写出第二步反应的热化学方程式(ΔH2用含ΔH、ΔH1的式子来表示):_______________________________________。
(2)温度为T1时,在两个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2(g),容器I中5min达到平衡。相关数据如表所示:
2NO(g)+O2(g),容器I中5min达到平衡。相关数据如表所示:
容器编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
①容器Ⅱ在反应的起始阶段向_____(“正反应”、“逆反应”、“达平衡”)方向进行。
②达到平衡时,容器I与容器Ⅱ中的总压强之比为___________
a. >1 b. =1 c. <1

(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:υ(NO2)=k1·p2(NO2),υ(N2O4)=k2·P(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间关系是k1=______;在上图标出点中,指出能表示反应达到平衡状态的点是_____,理由是______________。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:υ(NO2)=k1·p2(NO2),υ(N2O4)=k2·P(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间关系是k1=______;在上图标出点中,指出能表示反应达到平衡状态的点是_____,理由是______________。
(4)可用NH3去除 NO,其反应原理4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
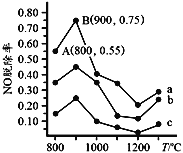
①曲线a中,NO的起始浓度为6×10-4 mg·m-3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为_______mg/(m3·s)。
②曲线b对应NH3与NO的物质的量之比是_____。
(5)还可用间接电解法除NO。其原理如图所示:
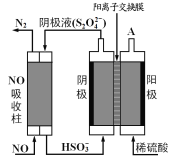
①从A口中出来的物质的是__________________。
②写出电解池阴极的电极反应式_______________。
③用离子方程式表示吸收池中除去NO的原理__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的Na2SO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11(忽略反应前后的体积变化),则Ba(OH)2溶液与Na2SO4溶液的体积比是( )
A.1:9B.1:1C.1:2D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:
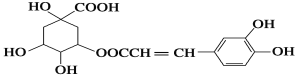
关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com