

分析 (1)①二氧化硫是酸性氧化物与NaOH反应生成了亚硫酸根和水;
②可在碘水中加入淀粉,当与二氧化硫加好反应时,溶液蓝色恰好褪去;
(2)①二氧化硫易溶于水,且与水反应生成亚硫酸被海水中氢氧根中和为亚硫酸根和亚硫酸氢根;
②当用氧气进行氧化反应时主要氧化还原性较强的亚硫酸根和亚硫酸氢根;
③氧气氧化后的海水因生产酸,使溶液呈酸性,而天然海水呈弱碱性;
(3)气体中物质的量减少等于反应的氧气的物质的量.
解答 解:(1)①二氧化硫是酸性氧化物与NaOH反应生成了亚硫酸根和水,反应的离子方程式为:SO2+2OH-═SO32-+H2O,故答案为:SO2+2OH-═SO32-+H2O;
②可在碘水中加入淀粉,当与二氧化硫加好反应时,溶液蓝色恰好褪去,这样可使现象明显,故答案为:淀粉;
(2)①二氧化硫易溶于水,且与水反应生成亚硫酸被海水中氢氧根中和为亚硫酸根和亚硫酸氢根,因利用天然海水吸收二氧化硫主要利用了二氧化硫易溶于水及酸性氧化物的性质,故答案为:AC;
②当用氧气进行氧化反应时主要氧化还原性较强的亚硫酸根和亚硫酸氢根,离子反应为2SO32-+O2═2SO42-或2HSO3-+O2═2SO42-+2H+,故答案为:2SO32-+O2═2SO42-或2HSO3-+O2═2SO42-+2H+;
③用氧气氧化后的海水因生产酸,使溶液呈酸性,而天然海水呈弱碱性,故将二者按适当比例混合后可达到排放的要求,故答案为:中和、稀释氧气氧化的海水中生成的酸;
(3)2SO2+O2?2SO3 △n=1
2 1 2
n(初)4.0 10.0 0
△n 2.0 1.0 2.0 14.0-13.0=1.0
n(平)2.0 9.0 2.0
则二氧化硫的转化率为$\frac{2.0mol}{4.0mol}$×100%=50%,故答案为:50%.
点评 本题考查了工业制硫酸的流程和生产装置的应用及尾气处理的方法,涉及酸碱中和反应、氧化还原反应及盐类水解等,综合性较强,侧重分析能力、知识迁移应用能力的考查,题目难度中等.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①② | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中少量O2:用点燃的方法 | |
| B. | 除去NaCl溶液中的Na2SO4:加入适量Ba(NO3)2溶液后,过滤 | |
| C. | 除去Cu中的少量Fe:加入足量稀硫酸溶液后,过滤,洗涤,干燥 | |
| D. | 除去CO2中的少量HCl:通入NaOH溶液后,收集气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60% | B. | 40% | C. | 33.3% | D. | 66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
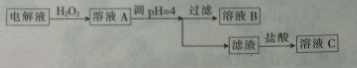
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com