
依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如下图所示。
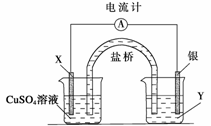
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________;
(2)银电极为电池的__________极,发生的电极反应为______________________;
X电极上发生的电极反应为_______________________________________________;
(3)外电路中的电子是从__________电极流向__________电极。
科目:高中化学 来源: 题型:
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
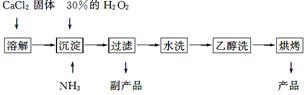
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是______________________________;
(2)检验“水洗”是否合格的方法是___________________________________________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是______________________;
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①第一步发生的反应的化学方程式为 ;
CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)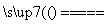 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+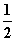 O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+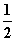 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:________________________________________________________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
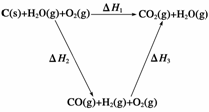
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是__________(填“甲”或“乙”);判断的理由是________________________________________________________________________
________________________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点:________________________________________________________________________
________________________________________________________________________。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1∶1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A极减轻;B、D相连时,B为正极。则四种金属的活动性顺序由大到小排列为( )
A.A>B>C>D B.A>C>B>D C.A>C>D>B D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
以锌片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2 mol电子时,下列说法正确的是( )
A.锌片溶解了1 mol,铜片上析出1 mol H2
B.两极上溶解和析出的物质质量相等
C.锌片溶解31 g,铜片上析出1 g H2
D.锌片溶解了1 mol,硫酸消耗0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
根据如图所示的反应判断下列说法中错误的是( )
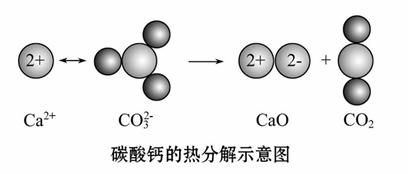
A.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
B.该反应的焓变大于零
C.该反应中有离子键断裂也有共价键断裂
D.由该反应可推出凡是需要加热才发生的反应均为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中短周期元素性质的数据判断,下列说法正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10 m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
A.①⑧形成的化合物具有两性
B.⑦位于第二周期第ⅥA族
C.④⑤形成的化合物是离子化合物
D.③的最高价氧化物对应的水化物碱性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com