
(12分)Al及其化合物用途广泛,工业上可以将明矾石经处理后得到明矾[KAl(SO4)2·12H2O],再将明矾焙烧后制得Al2O3等物质,进一步处理后还可以得到Al。
已知焙烧明矾的化学方程式为:
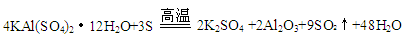
请回答:
(1)Al2O3的摩尔质量是 。
(2)工业上可用电解Al2O3制备Al,其化学方程式是 。
(3)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比是 。
(4)焙烧明矾时产生的SO2可综合利用来制硫酸。
已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1 = 一197 kJ/mol
2SO3(g) △H1 = 一197 kJ/mol
2H2O (g)=2H2O(1) △H2 = 一44 kJ/mol
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3 = 一545 kJ/mol
SO3(g)与H2O(l)反应的热化学方程式是 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式 。
②电池总反应的化学方程式 。
(12分)
(1) 102 g/mol (2分,数值、单位各1分)
(2) (2分,没写熔融态和冰晶石不扣分)
(2分,没写熔融态和冰晶石不扣分)
(3)2:1 (2分)
(4)SO3(g)+ H2O(l) = H2SO4(l) △H= -152kJ·mol-1 (2分)
(5)①Al-3e- + 4OH- = AlO2-+2H2O (2分)
②Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2 (2分)
【解析】
试题分析:(1)Al2O3的摩尔质量在数值等于相对分子质量,所以Al2O3的摩尔质量为:102 g/mol
(2)电解熔融的Al2O3生成Al和O2,所以化学方程式为:
(3)根据焙烧明矾的化学方程式 可知,氧化剂和还原剂的物质的量之比=6:3=2:1.
可知,氧化剂和还原剂的物质的量之比=6:3=2:1.
(4)首先写出SO3与H2O反应的化学方程式并注明状态:SO3(g)+ H2O(g) = H2SO4(l),然后根据盖斯定律计算焓变,?H=—1/2△H1+1/2△H2 +1/2 △H3 =-152kJ·mol-1,故热化学方程式为:SO3(g)+ H2O(l) = H2SO4(l) △H= -152kJ·mol-1
(5)①Al为活泼金属,在负极上失去电子,所以电极方程式为:Al-3e- + 4OH- = AlO2-+2H2O
②正极上NiO(OH)得电子转化为Ni(OH)2,可得电池总反应的化学方程式为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2
考点:本题考查摩尔质量、方程式的书写、氧化还原反应、原电池原理。


科目:高中化学 来源:2015届北京理工附中高三第一次月考化学试卷(解析版) 题型:选择题
氨水中有下列平衡NH3·H2O NH4++OH—当其它条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是
NH4++OH—当其它条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是
A、加NaOH B、加HCl C、加NH4Cl D、加同浓度的氨水
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:填空题
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+ ,由此说明:
,由此说明:
(1)H2O2的氧化性比Fe3+ ,其还原性比Fe2+ (填“强”或“弱”)
 (2)
(2) 在H2O2分解过程中,FeSO4溶液 的作用是
在H2O2分解过程中,FeSO4溶液 的作用是
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列各组离子中,因发生氧化还原反应而不能大量共存的是
A.Fe3+、H+、SO、ClO- B.Fe3+、Fe2+、SO、OH-
C.Al3+、Na+、SO、HCO3- D.K+、H+、I-、MnO
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
化学概念在逻辑上存在如下关系:
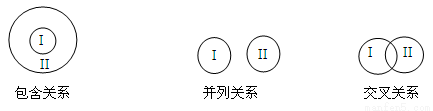
对下列概念的说法正确的是
A.电解质与非电解质属于包含关系
B.化合物与碱性氧化物属于包含关系
C.单质与化合物属于交叉关系
D.氧化还原反应与分解反应属于并列关系
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在 H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 该反应△H<0,平衡向生成NO2方向移动 |
D | 在密闭容器中有反应:A+xB(g) | A非气体、x=1 |
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.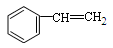 没有顺反异构体
没有顺反异构体
B.1,3-丁二烯可以作为合成高分子化合物的原料
C.用乙醇和浓硫酸制备乙烯时,用水浴加热控制反应温度
D.常温下,将苯酚加入到少量水中有浑浊,滴入适量NaOH溶液后浑浊消失
查看答案和解析>>
科目:高中化学 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:选择题
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C =2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:选择题
橄榄石型LiFePO4是一种锂离子电池正极材料,下列有关LiFePO4 的说法中不正确的是
A.LiFePO4中铁元素的化合价为+2价 B. LiFePO4 中Li、P、O均属于短周期元素
C.LiFePO4能与稀硫酸发生氧化还原反应 D.LiFePO4中Li、Fe、P均属于主族元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com