
【题目】以天然气代替石油生产液体燃料和基础化学品是当前化学研究和发展的重点。
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y和芳香烃Z等重要化工原料,实现了CO2的零排放,碳原子利用率达100%。已知Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种。
①有关化学键键能数据如表中所示:
化学键 | H-H | C=C | C-C | C≡C | C-H |
E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
写出甲烷一步生成乙烯的热化学方程式:_____________;
②已知:原子利用率=期望产物总质量/反应物总质量×100%,则甲烷生成芳香烃Y的原子利用率为______;
③生成1 mol Z产生的H2约合标准状况下________L。
(2)如图为乙烯气相直接水合法制备乙醇过程中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
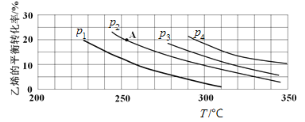
①若p2=8.0 MPa,列式计算A点的平衡常数Kp=_______(用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留到小数点后两位);
②该反应为______(填“吸热”或“放热”)反应,图中压强(p1、p2、p3、p4)的大小关系为_______;
【答案】2CH4(g)=C2H4(g)+2H2(g) ΔH=+166.6 kJ/mol 81.25% 358.4 0.07 放热 p1<p2<p3<p4
【解析】
芳香烃Y和芳香烃Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种,则Y为苯(C6H6)、Z为萘(C10H8)。明确一步合成的内涵后,再去解题。
(1)①化学反应的反应热等于反应物的键能总和与生成物的键能总和的差,根据甲烷一步生成乙烯的化学方程式2CH4→C2H4+2H2及相关的键能数据可知,该反应的ΔH=413.4 kJ/mol 42-413.4 kJ/mol 4-615 kJ/mol -436 kJ/mol 2=+166.6 kJ/mol,因此,甲烷一步生成乙烯的热化学方程式为2CH4(g)=C2H4(g)+2H2(g) ΔH=+166.6 kJ/mol;
②原子利用率=期望产物总质量/反应物总质量×100%,根据甲烷生成芳香烃Y的化学方程式6 CH4→C6H6+9 H2,可知甲烷生成芳香烃Y的原子利用率为![]() 81.25%;
81.25%;
③甲烷一步生产芳香烃Z的化学方程式为10 CH4→C10H8+16H2,生成1 mol Z产生的H2为16mol,约合标准状况下358.4L。
(2)乙烯气相直接水合法制备乙醇的化学方程式为CH2=CH2(g)+H2O(g)CH3CH2OH(g)。
①若p2=8.0 MPa,由图可知,A点乙烯的平衡转化率为20%,假设开始投料n(H2O)=n(C2H4)=1mol,则两反应物的变化量均为0.2mol,平衡混合物中CH2=CH2、H2O、CH3CH2OH的物质的量分别为0.8 mol、0.8 mol、0.2mol,其物质的量分数分别为![]() 、
、![]() 、
、![]() , 因此,A点的平衡常数Kp=
, 因此,A点的平衡常数Kp= 0.07;
0.07;
②由图像可知,乙烯的平衡转化率随温度升高而减小,故该反应为放热反应。由于正反应为气体分子数减少的方向,在相同温度下,压强越大乙烯的平衡转化率越大,因此,图中压强(p1、p2、p3、p4)的大小关系为p1<p2<p3<p4.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式,书写正确的是( )
A.盐酸与石灰石反应:CO32ˉ+2H+ = CO2↑+H2O
B.铁与稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
C.氢氧化铁胶体的制备:FeCl3 + 3H2O = Fe(OH)3+3HCl
D.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42ˉ = BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
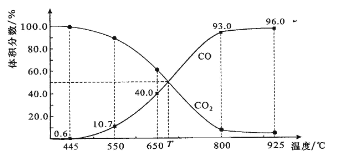
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解液不参与反应的情况下,采用电化学法还原CO2可制备ZnC2O4,原理如图所示。下列说法正确的是

A. 电解结束后电解液Ⅱ中c(Zn2+)增大
B. 电解液Ⅰ应为ZnSO4溶液
C. Pt极反应式为2CO2+2e=![]()
D. 当通入44 g CO2时,溶液中转移1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A.500 s内NO2的生成速率为2.96×10-3mol·L-1·s-1
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)﹤5.00mol/L
D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示电池是一种新型储氢材料—镍电池(MHn—Ni),(MHn中金属和氢都为 0 价)。下列有关说法不正确的是
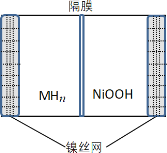
A.放电时正极反应为 NiOOH+H2O+e-→Ni(OH)2+OH-
B.电池的电解液可为KOH 溶液
C.充电时阴极反应为 MHn+nOH--e-→nH2O+M
D.MHn 是一类储氢材料,n 越大,电池的比能量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各对物质,互为同系物的是( )
A. CH3CH2C1与CH3CHCl﹣CH2ClB. CH3COOH与CH3CH2COOCH3
C.  与
与 D.
D. ![]() 与
与![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4℃时在100mL水中溶解了22.4L氯化氢气体(在标准状况下测得)。下列关于所形成的溶液说法中,正确的是( )
A. 该溶液溶质的物质的量浓度为10mol·L-1
B. 若已知该溶液的密度,则可求得溶液溶质的物质的量浓度
C. 该溶液中含有0.1mol的Cl-
D. 该溶液的体积为22.5L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“实验结论”与“实验操作及现象”相符的一组是
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入 | 该溶液中一定含有 |
B | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
C | 向某溶液中加入 | 该溶液中一定含有 |
D | 向某溶液中加入酚酞溶液,溶液变为红色 | 该溶液中一定含有 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com