
【题目】只改变一个影响因素,平衡常数K与平衡移动的关系叙述不正确的是
A.K值不变,平衡可能移动
B.平衡向右移动时,K值不一定移动
C.K值有变化,平衡一定移动
D.相同条件下,同一个反应的方程式的化学计量数增大2倍,K值也增大两倍
科目:高中化学 来源: 题型:
【题目】花椒毒素可用于治疗白癫风等皮肤顽疾,其关键中间体H的合成路线如下:
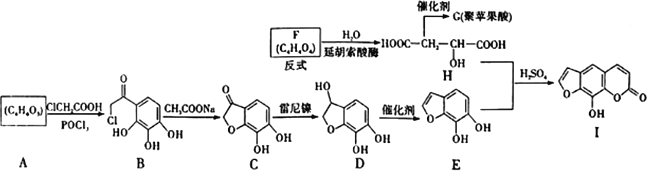
回答下列问题
(1)D中含氧官能团是____________(填名称)。A→B,B→C均为取代反应,则A的结构简式为__________________;B→C生成无机产物是_________________________。
(2)花椒毒素比Ⅰ多1个CH2,则花椒毒素的分子式为____________________。
(3)H→G反应的化学方程式为______________________________(只写1个)。
(4)芳香化合物W是D的同分异构体,W苯环上只有3个取代基且W含有2个酚羟基和羧基的结构共有______种,其中核磁共振氢谱为五组峰的结构简式为__________________________。
(5)参照上述合成路线,以苯酚和ClCH2COOH为原料(无机试剂任选),设计制备 的合成路线:_______________________________________________。 (合成路线流程图示例:
的合成路线:_______________________________________________。 (合成路线流程图示例:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤及硫酸工业尾气中的SO2是重要的大气污染物,可以用以下方法处理尾气中的SO2,
方法一:通过活性炭作用回收
2C(s)+2SO2(g)![]() S2(g)+2CO2(g)
S2(g)+2CO2(g)
(1)上述反应的化学平衡常数表达式为 _____________________;若在某密闭容器中进行上述反应,为了加快吸收SO2,可采取的措施有_____________________________________。
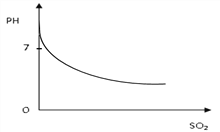
方法二:利用亚硫酸钠溶液进行吸牧
(2)把尾气(含二氧化硫)不断通入到饱和亚硫酸钠溶液中,生成亚硫酸氢钠,pH值的变化如图所示,请根据图示,解释PH值变化的原因:_______________________________________。
方法三:利用氯气和干燥的二氧化硫在活性炭催化剂存在下反应制取氯化硫酰:氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。
SO2(g)+Cl2(g)![]() SO2Cl2(l)+97.3kJ
SO2Cl2(l)+97.3kJ
(3)若反应的容器体积为2L,2分钟内液体质量增加了2.7克,用二氧化硫表示这两分钟内的化学反应速率______________________。
(4)若在此条件下,提高SO2的转化率,可采取的措施有____________________________________;当_________________________________________时说明上述反应已达到平衡状态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是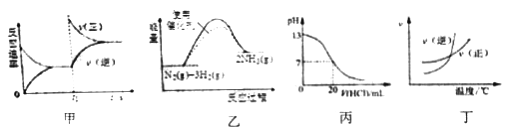
A. 图甲表示t1时刻增加反应物浓度后v(正)和v(逆)随时间的变化
B. 图乙表示反应N2(g)+3H2(g)![]() 2NH3(g)△H<0在两种条件下物质能量随反应过程的变化
2NH3(g)△H<0在两种条件下物质能量随反应过程的变化
C. 图丙表示25℃时,用0.1mol/L盐酸滴定20mL0.1mol/L氨水时,溶液pH随加入盐酸体积的变化
D. 图丁表示的反应正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱除工业尾气中的二氧化硫气体对物质的充分利用和环境保护有重要意义。
(1)某温度下,二氧化硫溶于水后所得溶液中H2SO3、HSO3-和SO32-占三种粒子总数的比例随pH 的变化如图所示。则在pH 为3时,溶液中H2SO3、HSO3-和SO32-的浓度最大的为_____。该温度下H2SO3 的电离平衡常数Ka1=_________。
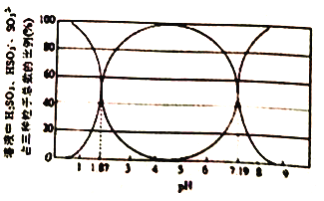
(2)利用尿素[CO(NH2)2]水解的溶液可以吸收空气中含有的SO2。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O![]() H2NCOONH4 (氨基甲酸铵)。
H2NCOONH4 (氨基甲酸铵)。
①当该反应处于平衡状态时,下列措施中有利于提高尿素水解程度的是____(填字母)。
a.升高反应温度 b.延长反应时间
c.增大尿素的浓度 d.向装置中充入SO2和空气混合物
②氨基甲酸铵会与空气中的SO2和O2反应:2 H2NCOONH4 (aq)+2SO2(g)+2O2(g)+H2O![]() 2(NH4)2SO4(aq )+2CO2(g),判断该反应达到平衡状态的标志是_______(填字母)。
2(NH4)2SO4(aq )+2CO2(g),判断该反应达到平衡状态的标志是_______(填字母)。
a.SO2和CO2浓度相等 b. SO2百分含量保持不变
c.容器中气体的压强不变 d.CO2的生成速率与SO2的消耗速率相等
③尿素溶液吸收SO2的吸收率随溶液的pH变化如图所示。尿素溶液吸收空气中的SO2后溶液的pH 会降低,为提高SO2 的吸收率和充分回收产物,应控制溶液pH 为_____。
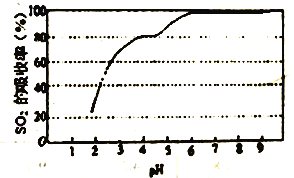
(3)工业上也常用氨水吸收SO2 。25℃时将SO2通入氨水中,当产物恰好为NH4HSO3时,溶液为_____ (填酸性、中性或碱性)。当c(OH-)降至1.0×10-7mol/L时,溶液中的c(SO32-)/c(HSO3-)=__________。己知25℃,NH3·H2O 的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示1 g O2与1 g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是
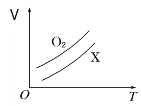
A. C2H4 B. CH4
C. CO2 D. NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下。
主反应 2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反应CH3CH2OH![]() H2C=CH2↑+H2O
H2C=CH2↑+H2O

【乙醚制备】装置设计如下图(部分装置略)
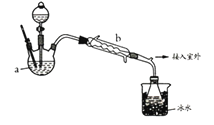
(1)仪器a是__________(写名称);仪器b应更换为下列的_______(填序号)。
A.干燥器 B.直形冷凝管 C.玻璃管 D.安全瓶
(2)实验操作的正确排序为___________(填序号),取出乙醚立即密闭保存。
a.安装实验仪器 b.加入12mL浓硫酸和少量乙醇的混合物c.检查装置气密性
d.熄灭酒精灯 e.通冷却水并加热烧瓶 f.拆除装置 g.控制滴加乙醇速率与馏出液速率相等 (3)加热后发现a中没有添加碎瓷片,处理方法是___________________;反应温度不超过145℃,其目的是___________________________。若滴入乙醇的速率显著超过馏出液速率,反应速率会降低,可能原因是__________________________。
【乙醚提纯】
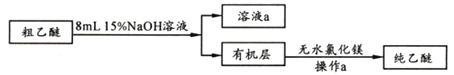
(4)粗乙醚中含有的主要杂质为_____________;无水氯化镁的作用是_____________________。
(5)操作a的名称是____;进行该操作时,必须用水浴代替酒精灯加热,其目的与制备实验中将尾接管支管通入室外相同,均为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com