
硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
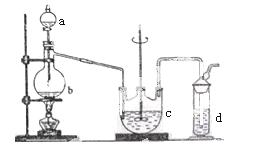
(1)b中反应的离子方程式为__________________,c中试剂为_______________ ______。
______。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________________。
(3)d中的试剂为____________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______________________。
科目:高中化学 来源: 题型:
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为
2NH3(g)+NO(g)+NO2(g)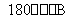 2N2(g)+3H2O(g) ΔH<0
2N2(g)+3H2O(g) ΔH<0
在恒容的密闭容器中,下列有关说法正确的是 ( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气净化中的一个反应如
下:
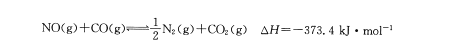
在一容积为5L的恒容密闭容器中充人0.2 mol NO和0.5mol CO,5 min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
A.达到平衡后,若只升高温度,化学平衡正向移动
B.达到平衡后,再通人稀有气体,逆反应速率增大
C.使用催化剂,平衡常数不变
D.0~5 min内,NO的反应速率为2.4×1 0-3 mol·L一1·min一1
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
①步骤3中加氨水后的离子方程式______________________
____________________________________________________。
②步骤4为加快过滤速度,常用____________________ (填过滤方法)。
(2)测定合成的MgCO3·nH2O中的n值。
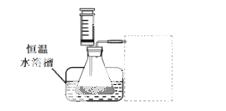
称量1.000 g碳酸镁晶须,放入下图所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
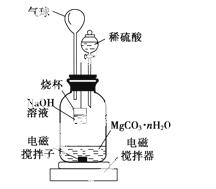
①图中气球的作用是____________________。
②上述反应后期要升温到30 ℃,主要目的是______________。
③设3次实验测得每1.000 g碳酸镁晶须产生的CO2平均值为a mol,则n值为____________________(用含a的表达式表示)。
(3)称取100 g上述晶须产品进行热重分析,热重曲线如下图。则该条件下合成的晶须中,n=____________(选填:1、2、3、4、5)。
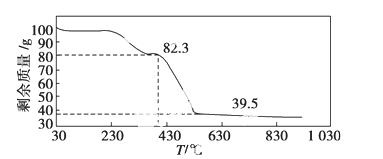
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol∙L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:__ __________
__________
②设计实验方案:在不同H2O2浓度下,测定 ____________________________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成下图的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
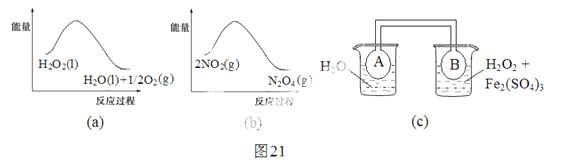
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。
(1)写出制取过程中反应的离子方程式:
________________________________________________________________________,
________________________________________________________________________。
(2)请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器)
①用蒸馏水完全溶解CaCl2后,加入
________________________________________________________________________。
②将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-。
③加入__________________________________________________________________,使沉淀完全溶解。
④_______________________________________________________________________,
得到纯净的硝酸钙晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究。
[实验一]探究浓硫酸的氧化性,将实验室常用的药品放入如图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
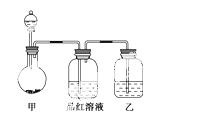
(1)该装置设计上存在明显缺陷,请指出:_______________________________。
(2)写出装置甲中反应的化学方程式:______________________________
__________________。装置乙中的试剂是:_______________________。
[实验二]探究某硫酸亚铁盐固体是否变质
(3)请你帮助小明同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)
M(g)+N(g)
所得实验数据如下表:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
回答下列问题:
(1)实验①中,若5min时测得,n(M)=0.050mo1, 则0至5min时间内,用N表示的平均反应速率为________。
(2)实验③平衡常数为___________,该正反应为____________反应(填“吸热”或“放热”)
(3)能说明上述反应一定达到平衡的条件是_______________________。
A. c(Y)= c(N) B.平均分子量不再变化
C. v正(X) =v逆(M) D.温度和压强一定时,混合气体的密度不再变化
(4)实验③中,达到平衡时,X的转化率为_________________________。
(5)实验③、④中,达到平衡时,a与b的关系为__________(填选项),请解释原因________________。
A. a>2b B. a=2b C.b<a<2b D.a<b
(6)图是实验①中c(M)随时间变化的曲线图,请在图中画出实验②中c(M)随时间变化的曲线图。

查看答案和解析>>
科目:高中化学 来源: 题型:
已知2Zn(s)+O2(g)= 2ZnO(s);ΔH=-700 kJ/mol,则1 g Zn在氧气中燃烧放出的热量约为( )
A.5.4 kJ B.350 kJ C.3.5 kJ D.8.5 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com