
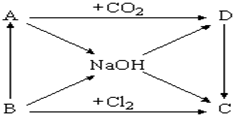
 如图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质.
如图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
| A、在标准状况下,NA个H2O所占的体积约为22.4L |
| B、8.4gNaHCO3溶解于水,电离生成的CO32-数目为0.1NA |
| C、1mol Cl2发生化学反应,转移的电子数一定为2NA |
| D、5.6g铁与氯气完全反应,失去电子的数目一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
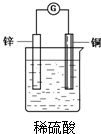 把一块锌片和一块铜片平行地插入盛有稀硫酸溶液的烧杯中,观察到的现象是
把一块锌片和一块铜片平行地插入盛有稀硫酸溶液的烧杯中,观察到的现象是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com