
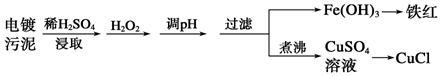
分析 工艺流程:电镀污泥中含有铜、铁等金属化合物.用酸浸取,再用双氧水氧化,可得硫酸铜和硫酸铁的混合溶液,调节PH值,使铁离子产生氢氧化铁沉淀,过滤得氢氧化铁固体,再将氢氧化铁固体加热分解得氧化铁,过滤得滤液中含有硫酸铜,向CuSO4溶液中加入一定量的NaCl、Na2SO3,将铜离子还原成亚铜离子,生成白色的CuCl沉淀,
(1)根据双氧水的性质分析,双氧水有氧化性,能氧化还原性的物质;根据过滤操作的原理、使用的仪器进行分析解答即可;
(2)CuSO4中+2价的铜具有氧化性能氧化Na2SO3中+4价的硫;
(3)根据关系式计算n(CuCl),进而计算样品中m(CuCl),计算0.2500g合格的CuCl中含有CuCl的质量,进行比较判断;
(4)依据平衡常数的概念结合反应写出计算式计算平衡浓度解答.
解答 解:(1)电镀污泥中含有铜、铁等金属化合物,酸浸后主要是溶解铜、铁等金属化合物,双氧水有强氧化性,能氧化还原性的物质,Fe2+具有还原性,酸浸后加入H2O2,Fe2+能被双氧水氧化为高价离子,便于调整pH值与Cu2+分离,调pH步骤中加入的试剂最好是加入某种物质除去溶液中的酸且不引进新的杂质,所以要加入氧化铜、或氢氧化铜、碳酸铜,当溶液的pH值4.4时,铜离子开始出现沉淀,当溶液的pH值为3.2时,三价铁离子沉淀完全,铜离子未产生沉淀,所以要使三价铁离子和铜离子分离,过滤操作用到的仪器有铁架台、漏斗、烧杯、玻璃棒等;其中属于玻璃仪器有:漏斗、烧杯、玻璃棒,
故答案为:将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离;CuO、或Cu(OH)2、或CuCO3;漏斗、烧杯、玻璃棒;
(2)CuSO4中+2价的铜能把Na2SO3中+4价的硫氧化成+6价的硫,向CuSO4溶液中加入一定量的NaCl、Na2SO3时生成白色的CuCl沉淀,反应的化学方程式为:2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4,
故答案为:2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4;
(3)设样品中CuCl的质量为x,有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+,则:
由化学反应方程式可知:CuCl~~~Fe2+~~~Ce4+
1 1
n(CuCl) 24.60×10-3L×0.1000 mol/L
所以 n(CuCl)=24.60×10-3L×0.1000 mol/L=2.46×10-3mol.
所以该样品CuCl的质量为2.46×10-3mol×99.5g/mol=0.2448g.
0.2500g合格的CuCl中含有CuCl的质量0.2500g×96.5%=0.2413g,小于0.2448g,所以该样品中CuCl的质量分数符合标准,
故答案为:符合;
(4)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,c(H+)=$\frac{1{0}^{-14}}{c(O{H}^{-})}$,反应Fe3++3H2O?Fe(OH)3+3H+的平衡常数K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$═$\frac{1{0}^{-42}}{c(F{e}^{3+}){c}^{3}(O{H}^{-})}$=2.5×10-5,
故答案为:2.5×10-5.
点评 本题是一道实验探究题,能较好的考查学生分析和解决问题的能力,考查了常见物质分离的方法,滴定计算等,注意实验方案的设计原理和步骤利用关系式计算,依据已有的知识结合物质间反应的实验现象进行物质成分的推断,是解答的关键,平时注意打好扎实的基础知识和灵活应用知识解决问题的能力培养,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| B. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| C. | 单位时间内消耗NO和N2的物质的量比为6:5时,反应达到平衡 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,15g甲醛和乙酸的混合物中O原子数为0.5NA | |
| B. | pH=1的稀硫酸中含有的H+数为0.1NA | |
| C. | 133g氯化铝分子中含有铝离子的个数为NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:| 滴定次数 | 滴定起始读数(mL) | 滴定终点读数(mL) |
| 第一次 | 1.08 | 如图 |
| 第二次 | 2.02 | 24.52 |
| 第三次 | 1.00 | 20.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO 32- NO3- SO42- SiO32- |
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 碱性的废水 | 用CO2来中和 | 化学法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干水和干冰是同一种物质 | |
| B. | 干水是纯净物 | |
| C. | 用干水吸收CO2有助于减缓温室效应 | |
| D. | 干水吸收CO2的过程只发生物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,当烧瓶中液体出现暴沸时,要立即添加碎瓷片 | |
| B. | 蒸发操作时,应使溶液蒸发至干,以保证得到的固体中没有任何水分 | |
| C. | 分液操作时,分液漏斗中下层液体先从下口放出,再让上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HBr<HCl<HF | B. | 原子半径:I<Br<Cl | ||
| C. | 酸性:HClO4<HBrO4<HIO4 | D. | 非金属性:F<Cl<Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com