


分析 (1)甲烷燃烧生成二氧化碳和水,据此书写化学方程式;
(2)①由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气;
②燃料在负极失电子发生氧化反应,碱性条件下生成碳酸盐和水,结合电子守恒和电荷守恒、原子守恒配平书写电极反应;
(3)钢铁腐蚀,在电解质溶液为中性溶液水膜时发生的是吸氧腐蚀,铁做负极失电子发生氧化反应,杂质碳做正极,溶液中氧气得到电子发生还原反应,结合电子守恒计算;
(4)分离不溶性固体和溶液的方法是溶解、过滤,碘离子和双氧水发生氧化还原反应生成碘单质和水,根据萃取剂的选取标准判断.
解答 解:(1)甲烷燃烧生成二氧化碳和水,反应的化学方程式为:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O,
故答案为:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O;
(2)①由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气,
故答案为:B;
②假设使用的“燃料”是甲醇,a极为负极,发生的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,b为正极,发生还原反应,电极方程式为O2+4e-+2H2O=4OH-,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)钢铁腐蚀,在电解质溶液为中性溶液水膜时发生的是吸氧腐蚀,铁做负极失电子发生氧化反应,电极反应为:Fe-2e-=Fe2+,杂质碳做正极,溶液中氧气得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-,电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2,当导线中有3.01×1023个电子流过,电子物质的量=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,被腐蚀的铁元素为0.25mol,质量=0.25mol×56g/mol=14g,
故答案为:O2+2H2O+4e-=4OH-; 14;
(4)分离不溶性固体和溶液的方法是溶解、过滤,碘离子和双氧水发生氧化还原反应生成碘单质和水,离子方程式为:H2O2+2I-+2H+=2H2O+I2,萃取剂的选取标准为:溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,两种溶剂不能互溶,萃取剂和溶质不反应,乙醇和乙酸能与水互溶,所以不能作萃取剂,苯和四氯化碳符合萃取剂的选取标准,所以可以作萃取剂,故选AC,
故答案为:溶解、过滤,H2O2+2I-+2H+=2H2O+I2,AC.
点评 本题考查较综合,涉及原电池原理、电极反应书写方法、钢铁腐蚀、物质分离、萃取剂的选取等知识点,题目难度不大,注意萃取剂的选取方法,为常考查点.


科目:高中化学 来源: 题型:选择题
| A. | 室温下,在水中的溶解度:丙三醇>苯酚>l一氯丁烷 | |
| B. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| C. | 用Na2CO3溶液不能区分CH3COOH 和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均能发生水解反应,且产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①②⑤ | C. | ②④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质参加或单质生成的化学反应一定是氧化还原反应 | |
| B. | 金属阳离子只有氧化性 | |
| C. | SO2具有较强还原性,浓H2SO4有很强的氧化性,不能用浓H2SO4干燥SO2 | |
| D. | 1molFe溶于过量硝酸,转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗2 mol SO2的同时生成1 mol O2 | |
| B. | 容器内气体总物质的量不再变化 | |
| C. | 反应平衡常数保持不变 | |
| D. | SO3的气体体积分数不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)写出基态镍原子的价电子排布图
(1)写出基态镍原子的价电子排布图 .
. )分子中2号碳原子的杂化方式为sp2杂化;与CS2互为等电子体的离子是SCN-(写一种).
)分子中2号碳原子的杂化方式为sp2杂化;与CS2互为等电子体的离子是SCN-(写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
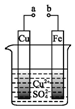
| A. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu | |
| B. | a和b不连接时,铁片上会有红色铜析出 | |
| C. | a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
 (标出配位键).
(标出配位键).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com