
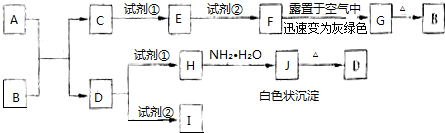
分析 F露置于空气中迅速变为灰绿色,为Fe(OH)2被氧化生成Fe(OH)3的变化,则F为Fe(OH)2,G为Fe(OH)3,可知B为Fe2O3,H加入氨水生成白色絮状沉淀,J为Al(OH)3,D为Al2O3,可知A、B的反应为铝热反应,A为Al,C为Fe,试剂①可为盐酸,②可为氢氧化钠等,I为NaAlO2,H为AlCl3等铝盐,以此解答该题.
解答 解:F露置于空气中迅速变为灰绿色,为Fe(OH)2被氧化生成Fe(OH)3的变化,则F为Fe(OH)2,G为Fe(OH)3,可知G为Fe2O3,H加入氨水生成白色絮状沉淀,J为Al(OH)3,D为Al2O3,可知A、B的反应为铝热反应,A为Al,C为Fe,试剂①可为盐酸,②可为氢氧化钠等,I为NaAlO2,H为AlCl3等铝盐,
(1)由以上分析可知A为Al,B为Fe2O3,F为Fe(OH)2,故答案为:Al;Fe2O3;Fe(OH)2;
(2)D为Al2O3,试剂②为强碱,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,H为AlCl3等铝盐,与氨水反应生成氢氧化铝,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al2O3+2OH-=2AlO2-+H2O;Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题考查无机物推断,为高考常见题型和高频考点,侧重考查学生的分析以及元素化合物知识的综合理解和运用的考查,题目涉及Al、Fe元素单质化合物的性质,物质的颜色是推断突破口,注意对基础知识的掌握,难度中等.


科目:高中化学 来源: 题型:选择题
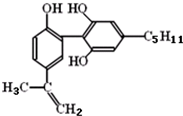
| A. | 该分子中所有碳原子一定共存于同一平面内 | |
| B. | 1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol | |
| C. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| D. | 滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | |
| B. | 前后两次平衡后,容器内的压强不相等次是相等 | |
| C. | SO2、O2的转化率均增大 | |
| D. | 通18O2前、通18O2后、重新到平衡后三个时间段,v(正)与v(逆)的关系依次是相等、大于、相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同状况下,同体积的乙醇气体和乙烯气体究全燃烧,耗氧量不相同 | |
| B. | 在相同状况下,同体积的乙醇气体和乙烯气体完全燃烧,放出的热量相同 | |
| C. | 用乙醇作燃料不会导致“温窒效应” | |
| D. | 用乙醇作燃料不会导致酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题:
X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 N,P,As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题:
N,P,As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题: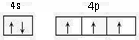 ,砷与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge.
,砷与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | HX是弱酸,其c(OH-)是该盐酸中c(OH-)的104倍 | |
| B. | N点的pH>7的原因是由于NaOH过量所致 | |
| C. | M点c(HX)<c(X-) | |
| D. | P点c(Cl-)=0.05mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com